Azeotrop
Bir azeotrop veya eşkaynar, oranları değiştirilemeyen veya basit damıtma ile ayrılamayan iki veya daha fazla sıvı karışımıdır.[1]
Bunun nedeni, bir azeotrop kaynatıldığında, buharın kaynamamış karışımla aynı oranlarda bileşenlere sahip olmasıdır. Bileşimleri damıtmayla değişmediği için azeotroplara (özellikle eski metinlerde) "sabit kaynama noktalı karışımlar" da denir.
Bileşik çiftlerinin bazı azeotropik karışımları bilinmektedir ve üç veya daha fazla bileşiğin birçok azeotropu da bilinmektedir.[2] Böyle bir durumda, bileşenleri fraksiyonel damıtma ile ayırmak mümkün değildir ve bunun yerine genellikle azeotropik damıtma kullanılır. İki tür azeotrop vardır: minimum kaynamalı azeotrop ve maksimum kaynamalı azeotrop. Raoult yasasından daha fazla pozitif sapma gösteren bir çözüm, belirli bir bileşimde minimum kaynamalı azeotropu oluşturur. Örneğin, fraksiyonel damıtmada (şekerlerin fermantasyonu ile elde edilen) bir etanol-su karışımı, en fazla %95 (hacimce) etanol içeren bir çözelti verir. Bu bileşim elde edildikten sonra, sıvı ve buhar aynı bileşime sahip olur ve daha fazla ayrılma olmaz. Raoult yasasından büyük negatif sapma gösteren bir çözüm, belirli bir bileşimde maksimum kaynama azeotropu oluşturur. Nitrik asit ve su, bu azeotrop sınıfının bir örneğidir. Bu azeotrop, 393,5 K (120,4 °C) kaynama noktasına sahip, kütlece %68 nitrik asit ve %32 sudan oluşan yaklaşık bir bileşime sahiptir.
Etimoloji
Azeotrop terimi Yunanca ζέειν (kaynama) ve τρόπος (dönme) kelimelerinden α- (yoksunluk ifadesi) ön ekiyle "kaynamada değişiklik yok" genel anlamını vermek için türetilmiştir. Terim, 1911'de İngiliz kimyager John Wade[3] ve Richard William Merriman[4] tarafından bulundu.
Türleri
Negatif ve pozitif azeotroplar
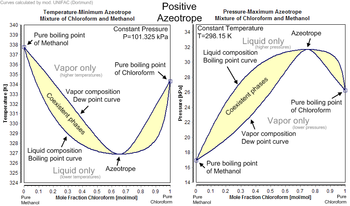

Her azeotropun karakteristik bir kaynama noktası vardır. Bir azeotropun kaynama noktası, bileşenlerinden herhangi birinin kaynama noktası sıcaklığından düşük (pozitif azeotrop) veya bileşenlerinden herhangi birinin kaynama noktasından yüksektir (negatif azeotrop).
Pozitif azeotropun iyi bilinen bir örneği, 78,2 °C'de kaynayan %95,63 etanol ve %4,37 sudur (kütlece).[5] Etanol 78,4 °C'de kaynar, su 100 °C'de kaynar, ancak azeotrop 78,2 °C'de kaynar; bu, bileşenlerinden herhangi birinden daha düşüktür.[6] Gerçekten de 78,2 °C, herhangi bir etanol/su çözeltisinin atmosferik basınçta kaynayabileceği minimum sıcaklıktır. Genel olarak, pozitif bir azeotrop, bileşenlerinin diğer herhangi bir oranından daha düşük bir sıcaklıkta kaynar. Pozitif azeotroplara ayrıca "minimum kaynama karışımları" veya "basınç maksimum azeotropları" da denir.
Genel olarak, negatif bir azeotrop, bileşenlerinin diğer herhangi bir oranından daha yüksek bir sıcaklıkta kaynar. Negatif azeotroplara ayrıca "maksimum kaynama karışımları" veya "basınç minimum azeotropları" da denir. Negatif azeotropa bir örnek, %20.2 ve %79.8 su (kütle olarak) konsantrasyonundaki hidroklorik asittir. Hidrojen klorür -84 °C'de ve su 100 °C'de kaynar, ancak azeotrop 110 °C'de kaynar, bu her bir bileşeninden daha yüksektir. Herhangi bir hidroklorik asit çözeltisinin kaynayabileceği maksimum sıcaklık 110 °C'dir.
Bileşen sayısı
İki bileşenden oluşan azeotroplara, bir zamanlar anestezide yaygın olarak kullanılan bir karışım olan dietil eter (%33) / halotan (%66) gibi ikili azeotroplar denir. Örneğin, benzen ve hekzaflorobenzen bir çift ikili azeotrop oluşturur.
Üç bileşenden oluşan azeotroplara üçlü azeotroplar denir, örn. aseton / metanol / kloroform. Üçten fazla bileşenin azeotropları da bilinmektedir.
Homojen ve heterojen azeotroplar
Bir karışımın bileşenleri birbirleriyle her oranda tamamen karışabiliyorsa, azeotrop tipine "homojen azeotrop" denir. Örneğin, homojen bir çözelti oluşturmak için herhangi bir miktarda etanol herhangi bir miktarda su ile karıştırılabilir.
Bileşenler tamamen karışabilir değilse, karışabilirlik boşluğu içinde bir azeotrop bulunabilir. Bu tür azeotropa "heterojen azeotrop" veya "heteroazeotrop" denir. Bir heteroazeotropik damıtma iki sıvı faza sahip olacaktır. Örneğin, aseton / metanol / kloroform, bir ara kaynama azeotropu oluşturur.
Örneğin, eşit hacimlerde kloroform (20 °C'de suda çözünürlüğü 0,8 g/100 ml) ve su birlikte çalkalanır ve ardından beklemeye bırakılırsa, sıvı iki katmana ayrılacaktır. Katmanların analizi, üst katmanın çoğunlukla içinde az miktarda kloroform çözülmüş su olduğunu ve alt katmanın çoğunlukla içinde az miktarda su çözülmüş kloroform olduğunu göstermektedir. İki katman birlikte ısıtılırsa katman sistemi, kloroformun (61,2 °C) veya suyun kaynama noktasından (100 °C) daha düşük olan 53,3 °C'de kaynar. Her iki katmanın da gerçekten mevcut olması koşuluyla, her bir sıvı katmanın ne kadarının mevcut olduğuna bakılmaksızın, buhar %97,0 kloroform ve %3,0 sudan oluşacaktır. Buhar yeniden yoğuşturulursa, katmanlar yoğuşma sıvısında yeniden şekillenecek ve bunu sabit bir oranda yapacaktır; bu durumda bu, üst katmandaki hacmin %4,4'ü ve alt katmandaki hacmin %95,6'sıdır.[7]
Zeotropi
Herhangi bir oranda karıştırıldığında azeotrop oluşturmayan solvent kombinasyonlarına "zeotropik" denir. Azeotroplar, zeotropik karışımları ayırmada faydalıdır. Bir örnek, bir azeotrop oluşturmayan asetik asit ve sudur. Buna rağmen, saf asetik asidi (kaynama noktası: 118,1 °C) bir asetik asit ve su çözeltisinden tek başına damıtma yoluyla ayırmak çok zordur. İleri damıtmalar gittikçe daha az su ile çözeltiler ürettikçe, her bir sonraki damıtma kalan suyu uzaklaştırmada daha az etkili hâle gelir. Çözeltiyi kuru asetik aside damıtmak bu nedenle ekonomik olarak pratik değildir. Ancak etil asetat, suyla 70,4 °C'de kaynayan bir azeotrop oluşturur. Çekici olarak etil asetat ekleyerek azeotropu damıtmak ve kalıntı olarak neredeyse saf asetik asit bırakmak mümkündür.
Bileşenlerin ayrıştırılması
İki solvent negatif bir azeotrop oluşturabilirse, bu bileşenlerin herhangi bir karışımının damıtılması, sonucunun orijinal karışımdan azeotroptaki bileşime daha yakın olmasına neden olacaktır. Örneğin, bir hidroklorik asit çözeltisi %20,2'den daha az hidrojen klorür içeriyorsa, karışımın kaynatılması, geride orijinalinden daha hidrojen klorür açısından daha zengin bir çözelti bırakacaktır. Çözelti başlangıçta %20,2'den fazla hidrojen klorür içeriyorsa, kaynama arkasında orijinalinden daha hidrojen klorür açısından daha fakir bir çözelti bırakacaktır. Herhangi bir hidroklorik asit çözeltisinin yeterince uzun süre kaynatılması, geride kalan çözeltinin azeotropik orana yaklaşmasına neden olur.[8]
Öte yandan, iki solvent pozitif bir azeotrop oluşturabilirse, bu bileşenlerin herhangi bir karışımının damıtılması, tortunun orijinal karışımdan azeotropta bileşimden uzaklaşmasına neden olacaktır. Örneğin, 50/50 etanol ve su karışımı bir kez damıtılırsa, damıtma ürünü (destilat, damıtık) %80 etanol ve %20 su olacaktır, bu da azeotropik karışıma orijinalinden daha yakındır, bu da geride kalan çözeltinin daha zayıf olacağı anlamına gelir.[9] %80/20 karışımın damıtılması, %87 etanol ve %13 su olan bir damıtık üretir. Daha fazla tekrarlanan damıtmalar, %95,5/4,5'lik azeotropik orana aşamalı olarak yaklaşan karışımlar üretecektir. Hiçbir sayıda damıtma, azeotropik oranı aşan bir damıtma ürünüyle sonuçlanmaz.
Kaynakça
- ^ Moore, Walter J. Physical Chemistry, 3rd e Prentice-Hall 1962, pp. 140–142
- ^ Department of Chemical Engineering University of Alicante. "Numerical Determination of Distillation Boundaries for Multicomponent Homogeneous and Heterogeneous Azeotropic Systems" (PDF). 1 Ekim 2011 tarihinde kaynağından (PDF) arşivlendi.
- ^ F. Gowland Hopkins (1913) "Obituary Notices: John Wade," Journal of the Chemical Society Transactions, 103 : 767-774.
- ^ Wade, John; Merriman, Richard William (1911). "Influence of water on the boiling point of ethyl alcohol at pressures above and below the atmospheric pressure". Journal of the Chemical Society, Transactions. 99: 997-1011. doi:10.1039/CT9119900997. 17 Mart 2023 tarihinde kaynağından arşivlendi. Erişim tarihi: 15 Mart 2023. From p. 1004: 17 Mart 2023 tarihinde Wayback Machine sitesinde arşivlendi. " … it is proposed, in order to avoid the cumbrous periphrase "mixtures having a minimum (or maximum) boiling point," to designate them as azeotropic mixtures (α, privative; ζέω, to boil)."
- ^ National Institute of Standards and Technology. "Standard Reference Material 1828: Ethanol-Water Solutions" (PDF). 8 Haziran 2011 tarihinde kaynağından (PDF) arşivlendi.
- ^ Rousseau, Ronald W.; James R. Fair (1987). Handbook of separation process technology. Wiley-IEEE. ss. 261-262. ISBN 978-0-471-89558-9.
- ^ CRC Handbook of Chemistry and Physics, 44th ed., p. 2156.
- ^ Merck Index of Chemicals and Drugs, 9th ed., monograph 4667
- ^ Clark, Jim (February 2014). "Non-Ideal Mixtures of Liquids". chemguide.co.uk. 20 Şubat 2008 tarihinde kaynağından arşivlendi. Erişim tarihi: 15 Mart 2023.












