Kromatografi, bir karışımın bileşenlerini, bunlara seçimsel ilgi gösteren iki ya da daha çok evreden sistemler arasında farklı göçlerine bakarak tanımak, gerektiğinde niceliklerini belirlemek amacıyla yapılan ve ayırma işlemine dayanan analitik yöntemdir.

Benzin, petrolden imal edilen bir tür yakıttır.
- 150 °C'a kadar ham benzin,
- 150-250 °C'a kadar gaz yağı, kerosen, jet yakıtı,
- 250-350 °C'a kadar dizel yakıtı,
- 350 °C'dan sonra da ağır yağlar elde edilir.

Kaynama noktası, sıvının buhar basıncının dış basınca eşit olduğu andaki sıcaklığıdır. Buhar basıncı yüksek olan sıvılar uçucudur ve kaynama noktaları düşüktür. Vakum işlemiyle buhar basıncı arttırılarak, kaynama noktası yüksek olan sıvılar oda sıcaklığında kaynatılabilir.
- Kaynama noktasına göre elementler
- Kaynama noktasına göre bazı çözücüler

Çözelti ya da solüsyon, iki ya da daha fazla maddenin herhangi bir oranda bir araya gelerek oluşturdukları homojen karışımdır.

Antifriz veya dondurmaz, 0 derece ve altında radyatör suyuna katılarak suyun donmasını önleyen kimyasal maddedir. Antifriz daha çok otomobil motorlarında kullanılır. Bir dialkol türü olan etilen glikol (etandiol) ve propilen glikol (propandiol) iyi birer antifrizdir. Yaygın antifrizler, sıvının kaynama noktasını arttırır ve daha yüksek soğutma suyu sıcaklığına izin verir.

Aerosol, bir katının veya bir sıvının gaz ortamı içerisinde dağılmasıdır. Duman, sis ve spreyler örnek olarak gösterilebilir. 10 mikrondan daha küçük çaplı sıvı veya katı parçacıklardan oluşan çok fazlı sistem. Son yıllarda aerosoller köpük veya jel şeklinde hazırlanmaktadır. Aerosoller; itici gaz, çözücü ve aerosol kabından oluşur. Aerosol kabı sprey kabı olarak da bilinir. İçindeki sıvıyı bir sis veya köpük hâlinde saçmak üzere düşünülmüş ve genellikle madeni bir kutu veya plastik bir şişe biçimindedir. Eskiden böcek ilaçlarını püskürtmek maksadıyla geliştirilen aerosol, günümüzde çok çeşitli ürünler için kullanılmaktadır. İtici gaz basınç altında tutulan sıvılaştırılmış gaz veya gazlar karışımıdır. Bu gazların kaynama noktası normal ısının altındadır. Bu sebeple itici gaz karışımı atmosfer ile temasa gelir gelmez süratla buharlaşır. Etken madde de saç veya cilt üzerinde kalır. Köpük ve toz aerosoller için de prensip aynıdır. İtici gaz olarak kullanılan maddelerin inert, kokusuz ve renksiz olmasına, toksik ve yanıcı olmamasına dikkat edilir. Bu amaçla fluorokarbonlardan trikloromonofluorometan, diklorodifluorometan çok kullanılmakla birlikte, son yıllarda ozon tabakasına verdiği zararlar sebebiyle terk edilip yerlerine propan, izobütan, n-bütan gibi gazlar veya karışımları kullanılmaktadır. Aerosollerin başlıcaları oda deodorantları ve saç laklarıdır. Aeorosoller yanlış kullanımda tehlikeli olabilir.

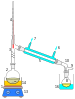
Damıtma ya da destilasyon, iki veya daha fazla bileşen içeren bir karışımın ısıtılıp, buhar ve sıvı faz oluşturmak suretiyle daha uçucu bileşence zengin karışımların elde edilmesini sağlayan ayırma işlemidir. Ayırma işlemi sırasında, buhar faz daha uçucu olan A bileşeni tarafından zenginleşirken, sıvı faz ise kaynama sıcaklığı daha yüksek olan B bileşenince zenginleşir. Fakat yüzde 100 A içeren bir buhar faz elde edilemez.

Kristalleştirme veya kristalizasyon, katı bir maddenin uygun bir çözücü içinde çözünmesi sonrasında çöktürülmesi yoluyla katı ve sıvı fazlarının birbirinden ayrılmasını sağlayan işlem.
Karışım, birden fazla maddenin kimyasal özellikleri değişmeyecek şekilde bir araya gelmesiyle oluşan madde topluluğudur. Saf maddeler element ve bileşiklerden oluşur. Fakat maddelerin çoğu ne tek bir elementtir ne de tek bir bileşiktir. Maddelerin çoğu saf madde olmayan karışımlardır. Karışımlar homojen, kolloid ve heterojen olmak üzere üçe ayrılır.

Uçucu yağ ya da organik hidrosol, çiçek veya bitki özsuları, distile özsuları veya bitki suları olup damıtma işleminin su içeren bir yan ürünüdür.
Çözücü veya solvent bir katıyı, sıvıyı ya da gaz çözünen maddeyi çözerek çözelti oluşturan sıvı ya da gaz maddedir. Günlük hayatta en yaygın çözücü sudur.

Kimyasal madde, kimyevî madde veya kısaca kimyasal, sabit bir kimyasal bileşimi ve karakteristik özelliklere sahip bir madde türüdür. Bu kimyasal bağlar bozulmadan, fiziksel ayırma yöntemleri ile bileşenlerine ayrılmaz. Bu kimyasallar katı, sıvı veya gaz hâlinde olurlar.

Basınçlı kazan, içinde çeşitli büyüklükte gaz veya sıvı basıncı bulunan kapalı bir kaptır.
Sıvı oksijen element halinde bulunan oksijenin fiziksel olarak sıvı halde bulunan çeşididir. Genellikle havacılık ve uzay, denizaltı ve gaz sanayinde kullanılır.

Kimyada, uçuculuk bir maddenin ne kolaylıkta buharlaştığını tanımlayan bir özelliktir. Belirli bir sıcaklık ve basınçta, yüksek uçuculuğa sahip bir maddenin buhar olarak bulunma olasılığı daha yüksekken, düşük uçuculuğa sahip bir maddenin sıvı ya da katı olma olasılığı daha yüksektir. Uçuculuk, bir buharın sıvı veya katı hâline yoğunlaşma eğilimini de tarif edebilir; daha az uçucu madde, yüksek uçucu maddelere göre buhardan daha kolay yoğunlaşacaktır. Uçuculuktaki farklılıklar, bir madde grubunun atmosfere açık olduğunda ne kadar hızlı buharlaştığını karşılaştırarak görülebilir. İspirto gibi yüksek derecede uçucu bir madde hızlı bir şekilde buharlaşırken, bitkisel yağ gibi düşük uçuculuğa sahip bir madde yoğuşmuş kalacaktır. Genel olarak, katılar sıvılardan daha az uçucudur, ancak bazı istisnalar da vardır. Kuru buz veya iyot gibi süblimleşen katı maddeler standart koşullar altında bazı sıvılarla aynı oranda buharlaşabilir.

Uçucu bir maddenin parlama noktası, bir tutuşturma kaynağı verildiğinde, madde buharının tutuşacağı en düşük sıcaklıktır.

Ayırma işlemi, bir kimyasal madde karışımını en az iki veya daha fazla ürüne dönüştürmek için kullanılan yönteme verilen addır. Ayırma işlemi sonucunda oluşan ürünlerden en az biri, kaynaktaki bileşenlerden en az biri ya da birden fazlası bakımından zenginleşir. Bazı durumlarda karışımlar bir ayırma işlemiyle neredeyse tamamen saf iki bileşene ayırabilir. Karışımın bileşenleri arasındaki fiziksel veya kimyasal farklarından yararlanılarak ayırma gerçekleştirilir.

İzoamil asetat veya izopentil asetat, izoamil alkol ve asetik asit esteri olan organik bileşik. Bu renksiz, yağımsı sıvı muz veya armuda benzeyen bir kokuya sahiptir parfümlerde koku, gıdalarda muz tadı vermek için kullanılır ayrıca sanayide çözücü olarak kullanılır. Bu madde doğal muzda az miktardada olsa oluşur muzların esans yağının bir parçasıdır. Toksititesi az ve az miktarlarda bile hissedildiğinden gaz maskelerini test etmek için kullanılabilir.

Modern öncesi kimya ve simyada kohobasyon, aynı maddenin sıvı ile tekrar tekrar damıtılmasıydı; o sıvı kabın tabanında kalan maddenin üzerine tekrar tekrar dökülüyor. Kohobasyon bir tür sirkülasyondur, ondan tek farkı sıvı maddenin ortak damıtmada olduğu gibi kohobasyonda çekilmesi ve tekrardan geri atılmasıdır; oysa dolaşımda, hiç dışarı çekilmeden aynı kapta yükselir ve alçalır.
Bir azeotrop veya eşkaynar, oranları değiştirilemeyen veya basit damıtma ile ayrılamayan iki veya daha fazla sıvı karışımıdır.