Asit, pH derecesi 7'den düşük olup, değişen oranlarda yakıcı ve/veya aşındırıcı özelliğe sahip olan ve oldukça geniş kullanım alanına sahip kimyasal maddelere verilen isimdir. Suda çözündüklerinde hidrojen iyonu derişimini artırarak çözeltiyi asidik yapar. Mavi turnusol kâğıdının rengini kırmızıya çeviren asitlere eski Türkçede hamız veya ekşit denir.

Fenolftalein, soluk sarı renkte, toz halinde bir organik bileşik. Formülü C20H14O4 olup, erime noktası yaklaşık 250 °C'dir. Alkolde çözünür. Fakat suda asla çözünmez. Fenolftalein sıcak sülfürik asit veya çinko klorür katalizörlüğünde fenol ile ftalik anhidridin reaksiyonundan elde edilir.
pH belirteçleri (İndikatörler), çözeltinin pH'sine bağlı olarak renk değiştiren, karmaşık yapıdaki organik bileşiklerdir. Bu tür bileşikler, asit ya da baz titrasyonunun bitiş noktasını saptamak amacıyla kullanılır. pH belirteçlerini asit, baz, redoks ve çöktürme belirteçleri olarak sınıflamak mümkündür.
Hidroliz işlemi suyu oluşturan hidrojen ve oksijen elementlerinin birbirinden ayrılması ile sonuçlanan bir işlemdir. Bazı kaynaklarda hidroliz, moleküllerin su ilavesiyle daha fazla sayıda parçacık oluşturması olarak da geçer. Hidroliz, su ile bir kimyasal bağın parçalanmasıdır yani bir kimyasal reaksiyondur. Hidroliz genel olarak suyun nükleofil olduğu ikame(yer değiştirme reaksiyonu), eliminasyon(organik reaksiyon türü) ve solvasyon (çözme) reaksiyonları için kullanılır.

Çözelti ya da solüsyon, iki ya da daha fazla maddenin herhangi bir oranda bir araya gelerek oluşturdukları homojen karışımdır.
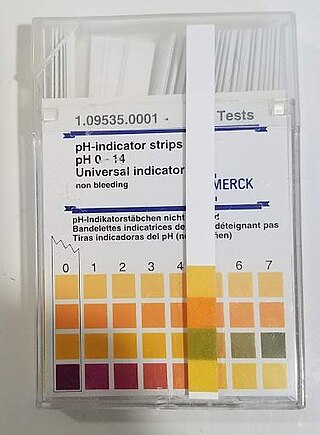
pH, bir çözeltinin asitlik veya bazlık derecesini tarif eden ölçü birimidir. pH'in açılımının ne olduğu kesin olarak bilinmese de genellikle "potential of hydrogen" veya "power of hydrogen" olduğu varsayılır.
Turnusol kâğıdı, kimyada kullanılan ayıraçlardan bir tanesidir. Çözeltilerdeki asit ve bazları ayırt etmekte kullanılır. Turnusol, asitle temas ettiğinde kırmızı, bazla temas ettiğinde mavi renk verir. Turnusol belirli likenlerden (kuzukulağı) elde edilen, içeriğinde orsein bulunan ve suda çözünen bir boyadır. Çözelti olarak veya bir filtre kâğıdına emdirilerek kullanılır. Bu kâğıda pH belirteci denir ve maddelerin asitliğini ölçmek için kullanılır. Mavi turnusol kâğıdı asidik ortamlarda kırmızıya ve kırmızı turnusol kâğıdı bazik ortamlarda maviye döner. Renk değişimi 4,5-8,3 pH aralığında menekşe tonlarında olur (25 °C'de). Turnusolün aktif maddesi eritrolitmindir. Düşük pH değerli maddeler asit olarak ve yüksek değerliler alkali olarak adlandırılır. Sadece asit ve bazlar değil, bazı çözünen tuzlar da turnusol kâğıdını mavi veya kırmızıya dönüştürür. Kuvvetli asit ve zayıf bazdan oluşan tuzlar asidik, zayıf asit ve kuvvetli bazdan oluşan tuzlar bazik özellik gösterdiğinden turnusolü boyarlar (hidroliz).
Alkaliler, suda çözünen bazlardır. Bir alkali çözeltisi, gösterge ilave edilerek tespit edilebilir. Örneğin bir sodyum hidroksit çözeltisi, turnusolü kırmızıdan maviye çevirir. Alkalik çözeltileri, hidroksit iyonları içerir. Asit ve alkali çözeltileri karıştığında, alkalideki hidroksit iyonları asitteki hidrojen iyonlarıyla tepkimeye girer ve suyu meydana getirir. Tuz tepkimenin diğer bir ürünüdür.

Kimyada amid sözcüğü iki anlama sahiptir: - Birinci anlamıyla amid, bir azot atomuna (N) bağlı bir karbonil grubu bulunduran bir organik fonksiyonel grup veya bu gruba sahip bir bileşiktir. - İkinci anlamıyla amid, bir azot anyonudur.

Hidroklorik asit, hidrojen ve klor elementlerinden oluşan, oda sıcaklığı ve normal basınçta gaz hâlinde olan hidrojen klorürün sulu çözeltisine verilen ad. Halk arasında tuz ruhu olarak da bilinir. 9. yüzyılda simyacı Câbir bin Hayyân tarafından keşfedildi ve sonrasında simya alanında kullanıldı. Sanayi Devrimi sırasında, sanayideki önemi keşfedilen asit, önce Leblanc işlemi, sonrasında Solvay işlemi ile sanayi alanında üretilmeye başladı. Hidroklorik asit, tarihte yeni kolaylıkların keşfinde önemli roller üstlendi. Günümüzde PVC'den demir-çeliğe, organik madde üretiminden gıda sektörüne kadar hemen hemen tüm alanlarda hidroklorik asit kullanılmaktadır.

Kongo kırmızısı, benzidindiazo-bis-1-naftilamin-4-sülfonik asit denilen asidin sodyum tuzudur. İkincil diazo boyasıdır. Kongo kırmızısı suda çözünebilir ancak etanol gibi organik çözücülerde daha iyi çözünür.

Hipokloröz asit, HOCl formülüne sahip bir zayıf asittir.
Bir asidin kuvveti, onun içinde bulunduğu çözeltiye ne kadar proton (H+) verebildiğinin ölçüsüdür. Kuvvetli asitler %100 çözünürler ve bu çözünme iyonlaşarak gerçekleşir. Yani 1 mol HA kuvvetli asidi suda çözündüğünde 1 mol H+ ve onun eşlenik bazı A- 1 mol oluşur. Hidroklorik asit, hidroiyodik asit, hidrobromik asit, perklorik asit, nitrik asit ve sülfürik asit, kuvvetli asitlere örnektir.

Çinko bromür (ZnBr2), ZnBr2 kimyasal formülüne sahip bir inorganik bileşiktir. Renksiz bir tuzdur ve çinko klorür (ZnCl2) ile pek çok ortak özellik taşır; organik çözücüler içinde çözünürler ve asiditesi yüksek çözeltiler oluşturmak üzere, su içinde yüksek çözünürlüğe sahiptirler. Higroskopiktir ve 2H2O·ZnBr2 dihidratını oluşturur.

İyodik asit, HIO3, beyaz veya kirli beyaz bir katı madde olarak elde edilebilir. Suda çok iyi çözünür, ancak klorik asit veya bromik asidin aksine saf halde bulunur. İyodik asit +5 oksidasyon durumunda iyot içerir ve halojenlerin saf halde en stabil okso-asitlerinden biridir. İyot asidi dikkatle ısıtıldığında pentoksit iyice dehidre olur. Daha sonraki ısıtmada, iyot pentoksit ayrıca iyot, oksijen ve düşük iyot oksitleri karışımı vererek ayrışır.

Hidrojen iyodür (HI) iki atomlu bir molekül ve hidrojen halojenürdür. Sulu çözeltisi, güçlü bir asit olan hidroiyodik asit veya hidriyodik asit olarak bilinir. Bununla birlikte, hidrojen iyodür ve hidroiodik asit, birincisinin standart koşullar altında bir gaz olması, diğerinin ise söz konusu gazın sulu bir çözeltisi olması bakımından farklıdır. Birbirine dönüştürülebilir. HI, organik ve inorganik sentezlerde birincil iyot kaynaklarından biri ve bir indirgeyici madde olarak kullanılır.

Hidrojen bromür, HBr formülüne sahip iki atomlu moleküldür. Renksiz bir bileşik ve bir hidrojen halojenürdür. Hidrobromik asit, su içinde bir HBr çözeltisidir. Hem HBr'nin susuz hem de sulu çözeltileri, bromür bileşiklerinin hazırlanmasında ortak reaktiflerdir.
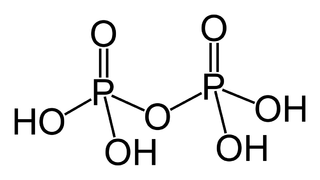
Difosforik asit olarak da bilinen pirofosforik asit, H4P2O7 formülüne sahip inorganik bir bileşik veya daha açıklayıcı olarak [(HO)2P(O)]2O'dur. Renksiz ve kokusuzdur, su, dietil eter ve etil alkolde çözünür. Susuz asit, 54.3 °C ve 71.5 °C'de eriyen iki polimorf içinde kristalleşir. Bileşik, polifosforik asit ve pirofosfat anyonunun konjugat asidinin bir bileşeni olması dışında özel olarak yararlı değildir. Pirofosforik asit anyonları, tuzları ve esterlerine pirofosfatlar denir.

Bromöz asit, HBrO2 formülüne sahip bir inorganik bileşiktir. Konjugat bazının -bromitlerinin- tuzları izole edilmiş olmasına rağmen, kararsız bir bileşiktir. Asidik çözeltide, bromitler broma ayrışır.

Potasyum iyodat (KIO3) bir kimyasal bileşiktir. K+ ve IO3− iyonlarından oluşur. Potasyum iyodat oksitleyici bir maddedir ve bu nedenle yanıcı maddelerle temas ettiğinde yangına neden olabilir. Suda ve sülfürik asitte çözünür; alkolde çözünmez.