
Termodinamik; ısı, iş, sıcaklık ve enerji arasındaki ilişki ile ilgilenen bilim dalıdır. Basit bir ifadeyle termodinamik, enerjinin bir yerden başka bir yere ve bir biçimden başka bir biçime transferi ile ilgilenir. Bu süreçteki anahtar kavram, ısının, belirli bir mekanik işe denk gelen bir enerji biçimi olmasıdır.

İdeal gaz yasası, sadece teoride olan ideal gazların durumları hakkında denklemler sağlayan bir yasadır. Bir miktar gazın durumu; basıncı, hacmi ve sıcaklığına göre belli olur. Bu denklem aşağıdaki gibidir:

- P paskal olarak basınç,
- V kübik metre olarak hacim,
- n gazın mol sayısı,
- R gaz sabiti
- T Kelvin olarak sıcaklık
Kimya yasaları, kimya ile ilgili olan doğa yasalarıdır.
Avogadro sayısı veya Avogadro sabiti, bir elementin bir molündeki atom sayısı ya da bir bileşiğin bir molündeki molekül sayısıdır. 1 mol yani 12 gr karbon12 elementindeki atom sayısı deneysel olarak hesaplanarak 6,02214199x1023 bulunmuştur. Sayı, bu alandaki katkılarından dolayı İtalyan bilim insanı Amedeo Avogadro'nun (1776–1856) adı ile anılır.

Fizik, fiziksel kimya ve mühendislikte akışkanlar dinamiği, akışkanların akışını tanımlayan akışkanlar mekaniğinin bir alt disiplinidir. Aerodinamik ve hidrodinamik dahil olmak üzere çeşitli alt disiplinleri vardır. Akışkanlar dinamiğinin, uçaklardaki kuvvetlerin ve momentlerin hesaplanması, boru hatları boyunca petrolün Kütle akış hızının belirlenmesi, hava durumu modellerinin tahmin edilmesi, uzaydaki bulutsuların anlaşılması ve fisyon silahı patlamasının modellenmesi dahil olmak üzere geniş bir uygulama yelpazesi vardır.

Avogadro sayısı kadar atom ya da molekül içeren maddeye 1 mol denir. Mol, hiçbir zaman belli bir kütleyi ifade etmez.

Genleşme, sıcaklığı artırılan bir cismin uzunluk ya da hacminin değişmesi olayıdır.
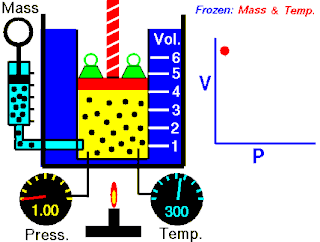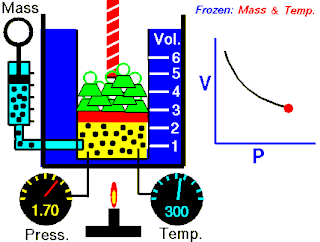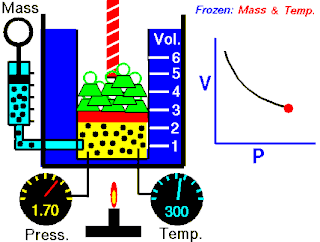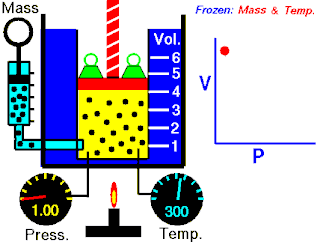
Boyle yasası, gaz yasalarından biridir. 1662'de İrlandalı doğa filozofu Robert Boyle tarafından ilk defa basılmıştır. Yasa, Richard Towneley ve Henry Power tarafından Boyle'ın önüne getirilmiş ve Boyle da deneyleri yapıp sonuçları basmıştır. Robert Gunther ve bazı diğer otoritelere göre, deneyin aparatını hazırlayan Boyle'ın asistanı Robert Hooke, yasayı formülize eden insan olabilir. Hooke'un matematik konusundaki becerileri Boyle'ı aşıyordu. Hooke ayrıca, deneyler için gerekli olan vakum pompalarını da icat etmiştir. Fransız fizikçi Edme Mariotte (1620-1684), Boyle'dan bağımsız olarak formülü 1676'da bulmuştur. Bu nedenle de bu yasa, Mariotte ya da Mariotte-Boyle yasası olarak da isimlendirilebilir.

Gaz yasaları, gazlardaki termodinamik sıcaklık (T), basınç (P) ve hacim (V) aralarındaki ilişkileri açıklayan bir takım kanundur. Rönesans'ın geç dönemleriyle 19. yüzyıl arasındaki dönemde bulunmuş birkaç yasadan oluşur.
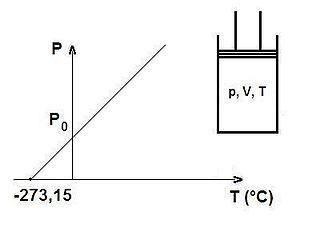
Charles yasası, gaz yasalarından biridir. Bu yasaya göre, sabit basınçta, herhangi bir miktardaki ideal gazın hacminin azalıp çoğalması, aynı oranda sıcaklığının da azalıp çoğalmasını etkiler.

Gay-Lussac yasası, Fransız kimyacı Joseph Louis Gay-Lussac'ın adıyla anılır. Gay-Lussac'a mal edilen, iki tane gaz yasası vardır. İkisi de aynı isimle anılırlar. En ünlü deneyi gazlarla yaptığı sıcaklık değişiminin inciler üzerindeki basınç değişimini dedesi Mark Lussac ile yapmıştır.
Bir ideal gaz karışımında hacmi olan her gazın kendine ait bir kısmi basıncı vardır.
Kinetik teori veya gazların kinetik teorisi, gazların basınç, sıcaklık, hacim gibi makroskobik özelliklerini moleküler bileşim ve hareketlerine bağlı olarak açıklayan teoridir. Esas olarak, teori Isaac Newton'un kanısının tersine basıncın moleküller arası statik itmeden kaynaklanmadığını, bunun yerine belli hızlarda hareket eden moleküller arası çarpışmalardan kaynaklandığını söyler. Kinetik teori aynı zamanda kinetik-moleküler teori veya çarpışma teorisi olarak da bilinir.
Boltzmann sabiti (k veya kB) enerji ile sıcaklık arasındaki ilişkiyi veren fiziksel bir katsayıdır. Entropi ile aynı birime sahip olup Avusturyalı fizikçi Ludwig Boltzmann'ın adını taşır. Formülü, gaz sabitinin Avogadro sayısına bölümünden oluşmaktadır ve şu şekilde gösterilir:


Dalton yasası, bir gaz karışımının toplam basıncının, karışımı oluşturan gazların kısmi basınçlarının toplamına eşit olduğunu açıklayan bir fiziksel kimya yasasıdır. Bu ampirik yasa John Dalton tarafından 1801 yılında deneysel olarak gözlemlenmiş ve 1802 yılında yayımlanmıştır. Dalton yasası ideal gaz kanunlarıyla ilgilidir.

Joule genişlemesi termodinamikte (ısıdevinimsel) geri dönülmez (tersinemez) bir süreçtir. Burada ısısal olarak yalıtılmış bölmeli kabın bir tarafına belli bir hacimde gaz konur, kalan diğer tarafı ise boşaltılmıştır. Kabın ortasındaki engel kaldırılır ve bir taraftaki gaz tüm kaba yayılır.

Termodinamik'in üçüncü yasası bazen ‘mutlak sıfır sıcaklığında dengede olan sistemlerin özelliklerine ilişkin’ olarak şu şekilde tanımlanır:
Fizikte, foton gazı, fotonların gaz benzeri birikmesidir ki hidrojen ve neon gibi sıradan gazlarla basınç, sıcaklık, entropi gibi benzer özelliklere sahiptir. Foton gazının dengedeki en yaygın örneği siyah cisim ışımasıdır.

İki izobarik yüzey arasındaki kalınlık, h tabakasının ortalama sanal sıcaklığına ilişkin bir denklemi verir.















