Kimya, maddenin yapısını, özelliklerini, birleşimlerini, etkileşimlerini, tepkimelerini araştıran ve uygulayan bilim dalıdır. Kimya bilmi daha kapsamlı bir ifadeyle maddelerin özellikleriyle, sınıflandırılmasıyla, atomlarla, atom teorisiyle, kimyasal bileşiklerle, kimyasal tepkimelerle, maddenin hâlleriyle, moleküller arası ve moleküler kuvvetlerle, kimyasal bağlarla, tepkime kinetiğiyle, kimyasal dengenin prensipleriyle vb konularla ilgilenir. Kimyanın en önemli dalları arasında analitik kimya, anorganik kimya, organik kimya, fizikokimya ve biyokimya sayılır.

Nükleik asitler, bütün canlı hücrelerde ve virüslerde bulunan, nükleotid birimlerden oluşmuş polimerlerdir. En yaygın nükleik asitler deoksiribonükleik asit (DNA) ve ribonükleik asit (RNA)'dır. İnsan kromozomlarını oluşturan DNA milyonlarca nükleotitten oluşur. Nükleik asitlerin başlıca işlevi genetik bilgi aktarımını sağlamaktır.

Tuz, kimyada, bir asitle bir bazın tepkimeye girmesi neticesinde meydana gelen maddedir. Tuz, asitteki eksi yüklü iyonla (anyon) bazdaki artı yüklü iyondan (katyon) meydana gelir. Asitle baz arasındaki nötralleşme tepkimesi esnasında tuz ve su açığa çıkar. Erimiş tuz veya çözelti halindeki tuzların çoğu eksi ile artı yüklü iyonlarına ayrışır ve elektriği iletir. Tuz adı ayrıca sofra tuzu veya sodyum klorür (NaCl) için de kullanılır.
Katalizör, bir kimyasal tepkimenin aktivasyon enerjisini düşürerek tepkime hızını artıran ve tepkime sonrasında kimyasal yapısında bir değişiklik meydana gelmeyen maddelerdir. Katalizörün tepkime üzerinde yaptığı bu değişikliğe kataliz denir. Kataliz olayı, katalizör ve reaktantlar aynı fazda ise homojen kataliz, katalizör ve reaktantlar farklı fazda olduğunda ise heterojen kataliz olarak adlandırılır. Heterojen kataliz mekanizmaları hâlâ tam olarak aydınlatılmış değildir.
Tampon, şu anlamlara gelebilir:
- Tampon bellek, bilgisayar dünyasında "bilgilerin topluca yazılması için arada biriktirildikleri yer".
- Araba tamponu, bir aracın arka ve önünde bulunan şok emici katman.
- Tampon, esas olarak kadınsı hijyen ürünü olarak kullanılan emici bir malzeme.
- Tampon bölge, düşman birlikleri, grupları ya da milletleri birbirinden ayırmak için oluşturulmuş ara bölge.
- Tampon devlet, iki güçlü ve birbirine husumet besleyen devletin arasında kurulan göreli olarak daha küçük ve güçsüz devlet.
- Tampon çözelti, zayıf asit ve konjuge bazın veya zayıf baz ve konjuge asitin karşımından oluşan sulu çözelti
- Tampon mekanizma, sosyoloji kavramı.
- Tampon, Türk punk rock grubu
- Tampon (jinekoloji), hijyen ürünü olarak kullanılan emici bir malzeme
Turnusol kâğıdı, kimyada kullanılan ayıraçlardan bir tanesidir. Çözeltilerdeki asit ve bazları ayırt etmekte kullanılır. Turnusol, asitle temas ettiğinde kırmızı, bazla temas ettiğinde mavi renk verir. Turnusol belirli likenlerden (kuzukulağı) elde edilen, içeriğinde orsein bulunan ve suda çözünen bir boyadır. Çözelti olarak veya bir filtre kâğıdına emdirilerek kullanılır. Bu kâğıda pH belirteci denir ve maddelerin asitliğini ölçmek için kullanılır. Mavi turnusol kâğıdı asidik ortamlarda kırmızıya ve kırmızı turnusol kâğıdı bazik ortamlarda maviye döner. Renk değişimi 4,5-8,3 pH aralığında menekşe tonlarında olur (25 °C'de). Turnusolün aktif maddesi eritrolitmindir. Düşük pH değerli maddeler asit olarak ve yüksek değerliler alkali olarak adlandırılır. Sadece asit ve bazlar değil, bazı çözünen tuzlar da turnusol kâğıdını mavi veya kırmızıya dönüştürür. Kuvvetli asit ve zayıf bazdan oluşan tuzlar asidik, zayıf asit ve kuvvetli bazdan oluşan tuzlar bazik özellik gösterdiğinden turnusolü boyarlar (hidroliz).

Kimyada esterler, bir hidroksil grubundaki hidrojen atomunun bir organik grup (bu metinde R' olarak gösterilecektir) ile yer değiştirmiş olduğu organik bileşiklerdir. Hidrojenin bir H+ iyonu olarak ayrışabileceği -OH grubu olan bu tür asitlere oksijen asidi denir.
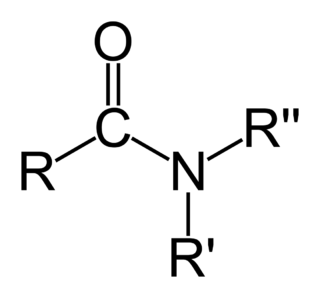
Kimyada amid sözcüğü iki anlama sahiptir: - Birinci anlamıyla amid, bir azot atomuna (N) bağlı bir karbonil grubu bulunduran bir organik fonksiyonel grup veya bu gruba sahip bir bileşiktir. - İkinci anlamıyla amid, bir azot anyonudur.
Kimyada bir dehidrasyon veya kondenzasyon tepkimesi, tepkiyen moleküllerden su kaybının meydana geldiği bir kimyasal tepkimedir. Dehidrasyon tepkimeleri eliminasyon tepkimelerinin bir alt grubudur. Hidroksil grubu (-OH) kolay ayrılan bir grup olmadığı için bir Bronsted asit katalizörü hidroksil grubunu protonlaştırıp daha kolay ayrılan bir -OH2+ grubu oluşturur. Selülozlar Bu gruba dahil değildirler.

Sülfürik(VI) asit ya da halk arasında bilinen ismi ile zaç yağı, H2SO4, güçlü bir mineral asididir. Olası kâşifi 8. yüzyıl simyacısı Cabir bin Hayyan tarafından yenime uğratıcı, renksiz ve yoğunluğu yüksek sıvı olarak tanımlanmıştır. Suda her konsantrasyonda çözünebilir. Büyük ölçüde korozif oluşu, güçlü asidik yapısından ve dehidrasyon özelliğinden kaynaklanmaktadır.
Oksit, içeriğinde en az bir adet oksijen atomu ve en az bir adet başka element içeren bileşiklere verilen genel isimdir. Soy gazlar oksitleri oluşturmazlar. OF2 ve KMnO4 oksit değildir.

Etil asetat (sistematik adıyla etil etanoat, kısa yazımla EtOAc veya EA), CH3COOCH2CH3 formüllü bir organik bileşiktir. Bu renksiz sıvı bileşiğin bazı yapıştırıcılar ve oje gibi tatlı bir kokusu vardır. Zehirli değildir. Etil asetat, etanol ve asetik asitin esteri olup, sanayide güçlü bir çözücü olması nedeniyle sık üretilen bir maddedir. Yapıştırıcılar, ojeler, oje çıkarıcılar ve kahveden kafeinin çıkarılmasında sıklıkla kullanılmaktadır.
Kimyasal reaktiflik, bir reaksiyonun meydana gelme eğilimiyle ilişkilidir. Kimyasal tepkimelerin gerçekleşmesini belirleyen faktörler termodinamik düzeyinde incelenir. Termodinamik olarak bir reaksiyon eğer tepkimenin ürünleri reaktanlara kıyasla daha düşük serbest enerji düzeyinde ise gerçekleşir. Diğer taraftan Reaktiflik ise genel olarak bir maddenin kimyasal değişikliklere ya da kimyasal tepkimelere girme eğilimine denir. Elementlerin atomik yapısı ve elektronlarının dizilişi elementlerin ve oluşturdukları moleküllerin reaktifliğinde önemli rol oynar. Soygazların örneğin kimyasal olarak çok az reaktiflik gösterdiği belirtilir. Dolayısıyla kimyasal bileşik oluşturmaları zordur. Bu durum soygazların tam dolu olan en dış elektron kabuğundan dolayıdır.
Kimyasal denge, asit ve baz kimyası, elektron aktarımı tepkimesi ve entropi gibi konular kimyasal reaktifliğin temel kavramlarıdır.
Alkin halojenürlerin katıldıkları bir başka tepkime çeşidiyse ayrılma tepkimeleridir. Bu tepkime esnasında molekülün yapısında bulunan XY gibi bir molekül alkil halojenürlerin yapısından ayrılır bunun sonucunda da çoklu bağlar oluşmaktadır.
Brønsted–Lowry asit–baz teorisi, Johannes Nicolaus Brønsted ve Thomas Martin Lowry'nin birbirlerinden bağımsız oluşturdukları bir asit-baz tepkime kuramıdır. Kuramın temel kavramı asitlerin proton (H+ iyonu) veren maddeler, bazların ise proton alan maddeler olarak tanımlanmasıdır.
Organik reaksiyonlar, organik maddelerin tepkimelerine verilen genel addır.
Pepsin; mide özsuyundaki et, yumurta gibi proteinli yiyeceklere tesir eden kuvvetli bir enzimdir. Anlamı Yunancada "πέψις (sindirim)" sözcüğünden gelmiş olup, 1836 yılında Theodor Schwann tarafından keşfi yapılmıştır. Yapı olarak büyük ve karmaşık bir moleküldür. Mide duvarında bulunan şef hücrelerince salgılanan pepsinojen ile mide özsuyunda bulunan hidroklorik asidin tepkimesi sonucu pepsin oluşur. 1929 yılında John Howard Northrop tarafından kristalize edilerek bu proteinin etki alanı keşfedilmiştir.

Bikarbonat tampon sistemi kandaki, onikiparmak bağırsaktaki ve diğer dokulardaki uygun metabolik işlevleri desteklemek amacıyla pH'ı koruyan, karbonik asit, bikarbonat iyonu ve karbondioksitin dengesini içeren bir asit-baz homeostaz mekanizması. Karbondioksit, hızlıca ve sırasıya bikarbonat ve hidrojen iyonlarına ayrışacak olan karbonik asiti oluşturmak için, suyla tepkime verir.Bu tepkime karbonik anhidraz ile katalize edilir.Tepkime aşağıda gösterilmiştir:

Hidrojen iyodür (HI) iki atomlu bir molekül ve hidrojen halojenürdür. Sulu çözeltisi, güçlü bir asit olan hidroiyodik asit veya hidriyodik asit olarak bilinir. Bununla birlikte, hidrojen iyodür ve hidroiodik asit, birincisinin standart koşullar altında bir gaz olması, diğerinin ise söz konusu gazın sulu bir çözeltisi olması bakımından farklıdır. Birbirine dönüştürülebilir. HI, organik ve inorganik sentezlerde birincil iyot kaynaklarından biri ve bir indirgeyici madde olarak kullanılır.

Asit saldırısı, şiddetli bir saldırı biçimidir. Bu tip saldırılarda hedef çoğunlukla şahsın yüzüdür ve kurban genellikle kadındır. Halk arasında kezzap atma olarak bilinse de aslında asit saldırılarında genelde kezzap değil sülfürik asit kullanılır. Nitrik asidin kullanıldığı vakalar da bulunmaktadır. Nadir olarak hidroklorik asit kullanılsa da sülfürik asit kadar güçlü değildir. Sülfürik asit, kezzaptan çok daha güçlüdür, sülfürik asidin su ile egzotermik bir tepkime vermesi deride üçüncü dereceden yanıklara sebep olmaktadır. Sülfürik asit ile gerçekleştirilen asit saldırılarına vitriolaj denir.








