
Arsenik sembolü As atom numarası 33 olan elementtir. Arsenik, çoğu mineralde, genellikle kükürt ve metallerle bir arada veya saf bir element kristali olarak bulunur. Arsenik bir metaloiddir. Çeşitli allotroplara sahiptir, ancak yalnızca metalik bir görünüme sahip gri form endüstri için önemlidir.

Antimon, sembolü Sb (Latince: stibiumʼdan) ve atom numarası 51 olan kimyasal elementtir. Parlak gri bir metaloid, doğada esas olarak bir kükürt minerali olan stibnit (Sb2S3) olarak bulunur. Antimon bileşikleri eski zamanlardan beri bilinmektedir ve genellikle ilaç ve kozmetik olarak kullanılmak üzere toz haline getirilmiştir. Metalik antimon da biliniyordu, ancak keşfinde yanlış olarak kurşun olarak tanımlandı. Batıda metalin bilinen en eski açıklaması 1540 yılında Vannoccio Biringuccio tarafından yazılmıştır.
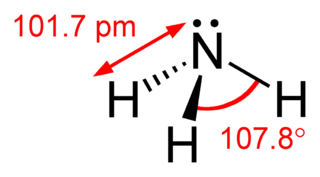
Amonyak, formülü NH3 olan; azot atomu ve hidrojen atomundan oluşan renksiz, keskin ve rahatsız edici kokulu bir bileşiktir. OH- iyonu içermediği hâlde suda zayıf baz özelliği gösterir. Bir amonyak molekülü, bir azot ve üç hidrojen atomundan oluşur. Oda sıcaklığında gaz hâlde bulunan bileşiğin ticari formu sulu çözeltiyi içermektedir.

Sodyum hipoklorit, (NaClO) bir tür tuzdur. Günlük hayatta beyazlatıcı çamaşır sularında kullanılmaktadır. Oda koşullarındaki klor ile sabunlardaki sodyum hidroksit tepkimeye sokularak üretilmektedir.

Hidrojen florür, formülü HF olan bir kimyasal bileşiktir. Bu renksiz gaz genellikle, hidroflorik asit gibi sulu çözelti formunda bulunur ve florun başlıca sanayi kaynağıdır. İlaç ve polimer endüstrisinde kullanılan önemli bileşiklerin öncüsüdür. HF petrokimya endüstrisinde yaygın olarak kullanılır ve birçok süperasitin bir bileşenidir. Hidrojen florür oda sıcaklığının hemen altında kaynar. Diğer hidrojen halojenürler ise çok daha düşük sıcaklıklarda kaynarlar. Diğer hidrojen halidlerden farklı olarak, HF havadan daha hafiftir ve gözenekli maddelerde oldukça çabuk şekilde yayılır.

Kakodilik asit (CH3)2AsO2H formülüne sahip bileşik. Kakodilik asitin türevleri sıklıkla herbisit olarak kullanılır.

Arsenik trioksit As2O3 formüllü inorganik bileşik.Ticari önemi bulunan bu arsenik oksiti, organoarsenik bileşiklerini de içeren diğer arsenik bileşiklerine ana öncüldür. Yıllık 50000 ton üretilir.
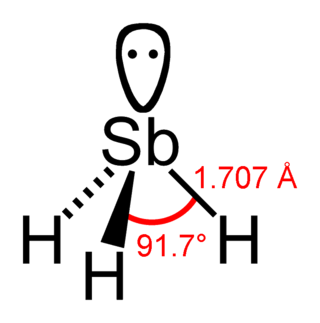
Stibin SbH3 formüllü bileşik. Son derece zehirli bir gaz olup çip üretiminde silisyuma antimon karıştırmak için kullanılır.

Organogalyum kimyası, karbon ve galyum arası kimyasal bağ gözlenen organometalik bileşiklerin kimyası. Yüksek toksisitelerine karşın organogalyum bileşiklerin organik sentez dalında bazı kullanım alanları vardır. Trimetil galyum ve MOCVD -trimetil galyumun arsin ile, 700 °C'de, tepkime vererek galyum arsenürün varlığını belirtmesi sebebiyle- bağlantı içerisindedirler:
- Ga(CH3)3 + AsH3 → GaAs + 3CH4

Arsenik pentoksit As2O5 formüllü inorganik bileşik. Camsı, beyaz ve nispeten dengesiz özüm veren katı madde. Arsenik bileşenlerinin tamamı toksiktir ve uygulama alanı çok kısıtlıdır.

Alüminyum hidrür (ayrıca bilinen adıyla alan veya alüman), formülü AlH3 olan inorganik bileşik. Renksiz, piroforik ve katı bir maddedir. Araştırma laboratuvarlarının dışında nadiren karşılaşılmasına rağmen, alan ve türevleri organik sentezlerde indirgen madde olarak kullanılır.

Sodyum borhidrür, olarak da bilinen sodyum tetrahidridoborat ve sodyum tetrahidroborat, NaBH4 formülüne sahip olan inorganik bir bileşiktir. Genellikle beyaz toz halinde olarak bulunur, kimya dalında hem laboratuvar hem de teknik ölçekde çok yönlü bir indirgeme ajanı olarak kullanılır. Odundan hamur hazırlamada test edilmiştir ancak ticari maliyeti çok yüksek çıkmıştır. Bileşik olarak alkolde ve bazı eterlerde çözünür. Suyla ise baz yoksunluğunda reaksiyona girer.

Sodyum bromür, NaBr formülüne sahip inorganik bir bileşiktir. Yüksek erime noktasına sahip beyaz kristal yapısıyla sofra tuzuna benzemektedir. Genellikle bromür iyonu kaynağı olarak çeşitli alanlarda kullanılmaktadır.
Sodyum hipobromit NaBrO formülüne sahip inorganik bir bileşiktir. Genellikle suyun kristalize edilmesiyle elde edildiğinden genel formülüne NaBrO.5H2O de denebilir. Sarı-turuncu renge sahip suda çözünebilir bir maddedir. İyonları Na+ BrO-'dur.

Paris yeşili inorganik bir bileşiktir. Yeşil pigment olarak Schweinfurt yeşili, zümrüt yeşili veya Viyana yeşili olarak da bilinir. Toksisitesine rağmen, bir rodentisit ve böcek ilacı, ve ayrıca bir pigment olarak kullanılan, oldukça toksik bir zümrüt yeşili kristal tozdur. Havai fişeklerde mavi renklendirici olarak da kullanılır. Paris yeşili renginin, çok ince öğütüldüğünde soluk mavi bir yeşille, kaba öğütüldüğünde daha derin bir yeşile kadar değiştiği söylenir.

Arsenöz asit (veya arsenik oksit), H3AsO3 formülüne sahip bir inorganik bileşiktir. Sulu çözeltilerde meydana geldiği bilinmektedir, ancak bu gerçek As(OH)3'ün öneminden uzaklaşmasa da saf bir malzeme olarak izole edilmemiştir.
Titanik asit, genel formül [TiOx(OH)4−2x]n ile titanyum, hidrojen ve oksijen elementlerinin kimyasal bileşiklerinin bir ailesi için genel bir isimdir. Esas olarak eski literatürde çeşitli basit titanik asitler talep edilmiştir. Bu malzemeler için kristalografik ve az spektroskopik destek yoktur. Brauer'in El Kitabı da dahil olmak üzere bazı eski literatür TiO2'den titanik asit olarak söz eder.
- Metatitanik asit (H2TiO3)
- Ortotitanik asit (H4TiO4) "TiO2·2.16H2O" altında beyaz tuz benzeri bir toz olarak tarif edilir.
- Peroksotitanik asit (Ti(OH)3O2H) ayrıca sülfürik asit içindeki titanyum dioksitin hidrojen peroksit ile işlenmesi sonucu da tarif edilmiştir. Elde edilen sarı katı O2 kaybı ile ayrışır.
- Pertitanik asit (H2TiO4)
- Pertitanik asit (TiO(H2O2)2+)

Kloroplatinik asit (hekzakloroplatinik asit olarak da bilinir), [H3O]2[PtCl6](H2O)x (0≤x≤6) formülüne sahip bir inorganik bileşiktir. Kırmızı bir katı, genellikle sulu bir çözelti olarak önemli bir platin kaynağıdır. Genellikle kısaca H2PtCl6 olarak yazılsa da, hekzakloroplatinat anyonunun (PtCl62-) hidronyum (H3O+) tuzudur. Hekzakloroplatinik asit oldukça higroskopiktir.
Hidrojen tellür (tellan), H2Te formülüne sahip bir inorganik bileşiktir. Bir hidrojen kalkojenür ve tellürün en basit hidrürü, renksiz bir gazdır. Ortam havasında kararsız olmasına rağmen, gaz çürümüş sarımsak benzeri kokusu tarafından son derece düşük konsantrasyonlarda kolayca tespit edilebilecek kadar uzun konsantrasyonlarda bulunabilir; ya da çürümüş pırasa benzeri biraz daha yüksek konsantrasyonlarda kokusu ile. Te–H bağları (tellüroller) olan bileşiklerin çoğu, H2 kaybı açısından kararsızdır. H2Te kimyasal ve yapısal olarak hidrojen selenüre benzer, her ikisi de asidiktir. H–Te–H açısı yaklaşık 90° 'dir. Uçucu tellür bileşikleri genellikle çürümüş pırasa veya sarımsak anımsatan hoş olmayan kokulara sahiptir.
Organik kimyada nitril, −C≡N fonksiyonel grubuna sahip herhangi bir organik bileşiktir. Siyano- ön eki, endüstriyel literatürde nitril terimi ile eş anlamlıdır. Nitriller, süper yapıştırıcılarda kullanılan metil siyanoakrilat ve lateks içermeyen laboratuvar ve tıbbi eldivenlerde kullanılan nitril içeren bir polimer olan nitril kauçuk dahil olmak üzere birçok yararlı bileşikte bulunur. Asetonitril çözücü olarak kullanılır.



















