Hidroliz işlemi suyu oluşturan hidrojen ve oksijen elementlerinin birbirinden ayrılması ile sonuçlanan bir işlemdir. Bazı kaynaklarda hidroliz, moleküllerin su ilavesiyle daha fazla sayıda parçacık oluşturması olarak da geçer. Hidroliz, su ile bir kimyasal bağın parçalanmasıdır yani bir kimyasal reaksiyondur. Hidroliz genel olarak suyun nükleofil olduğu ikame(yer değiştirme reaksiyonu), eliminasyon(organik reaksiyon türü) ve solvasyon (çözme) reaksiyonları için kullanılır.

Arsenik sembolü As atom numarası 33 olan elementtir. Arsenik, çoğu mineralde, genellikle kükürt ve metallerle bir arada veya saf bir element kristali olarak bulunur. Arsenik bir metaloiddir. Çeşitli allotroplara sahiptir, ancak yalnızca metalik bir görünüme sahip gri form endüstri için önemlidir.

Redoks atomların oksidasyon durumlarının değiştiği bir tür kimyasal reaksiyondur. Redoks reaksiyonları, kimyasal türler arasında elektronların fiili veya biçimsel aktarımı ile karakterize edilir, çoğunlukla bir tür oksidasyona, diğer türler indirgemeye uğrar. Elektronun çıkarıldığı kimyasal türlerin indirgenmiş olduğu söyleniyor. Başka bir deyişle:
- Oksidasyon, elektronların bir atom ya da molekülden ayrılmasını sağlayan kimyasal tepkimedir.
- Redüksiyon, bir atomun elektron almasını sağlayan kimyasal tepkimedir.

Klorik asit (HClO3), klorun bir oksoasiti ve klorat tuzlarının formal öncülüdür. Güçlü bir asit (pKa ≈1) ve oksitleyici ajandır.

Sodyum perklorat formülü NaClO4 olan bir kimyasal bileşiktir. Perklorik asitin sodyum tuzu olan bu bileşik diğer perkloratlar gibi kuvvetli bir oksitleyicidir. Sodyum perkloratın çözünürlüğü diğer perklorat tuzları içinde en yüksek olanıdır. Beyaz kristallerden oluşan ve higroskopik özellikte olan sodyum perklorat suda ve alkolde oldukça çok çözünür. Genellikle monohidrat form halinde bulunur ve rombik bir kristal yapısına sahiptir. Standart oluşum entalpisi −382.75 kJ mol−1 dir.

Kükürtlü asit, sülfüröz asit ya da sülfürik(IV) asit formüllü H2SO3 olan bir kimyasal bileşiktir.

Sodyum bisülfat, diğer bir adı sodyum hidrojen sülfat (NaHSO4) olan bu kimyasal madde asit tuz karakterlidir. Kuru halde iken güvenli bir şekilde nakledilebilir ve depolanabilir. Susuz formu higroskopiktir. Sodyum bisülfat suda hidroliz olarak asidik çözelti verir. 1 Molarlık çözeltisinin pH değeri 1 den küçüktür. Sodyum bisülfat yavaşça ısıtılırsa suyunu kaybederek sodyum pirosülfata dönüşür.
- 2NaHSO4 → Na2S2O7 + H2O

Sodyum iyodat, (NaIO3) iyodik asitin sodyum tuzudur. Sodyum iyodat oksitleyici madde olduğundan,yanıcı maddeler ya da indirgeyici maddelerle temas ettiğinde alev almalarına sebep olabilir.
Kimyasal reaktiflik, bir reaksiyonun meydana gelme eğilimiyle ilişkilidir. Kimyasal tepkimelerin gerçekleşmesini belirleyen faktörler termodinamik düzeyinde incelenir. Termodinamik olarak bir reaksiyon eğer tepkimenin ürünleri reaktanlara kıyasla daha düşük serbest enerji düzeyinde ise gerçekleşir. Diğer taraftan Reaktiflik ise genel olarak bir maddenin kimyasal değişikliklere ya da kimyasal tepkimelere girme eğilimine denir. Elementlerin atomik yapısı ve elektronlarının dizilişi elementlerin ve oluşturdukları moleküllerin reaktifliğinde önemli rol oynar. Soygazların örneğin kimyasal olarak çok az reaktiflik gösterdiği belirtilir. Dolayısıyla kimyasal bileşik oluşturmaları zordur. Bu durum soygazların tam dolu olan en dış elektron kabuğundan dolayıdır.
Kimyasal denge, asit ve baz kimyası, elektron aktarımı tepkimesi ve entropi gibi konular kimyasal reaktifliğin temel kavramlarıdır.
Sodyum hipobromit NaBrO formülüne sahip inorganik bir bileşiktir. Genellikle suyun kristalize edilmesiyle elde edildiğinden genel formülüne NaBrO.5H2O de denebilir. Sarı-turuncu renge sahip suda çözünebilir bir maddedir. İyonları Na+ BrO-'dur.

İyodik asit, HIO3, beyaz veya kirli beyaz bir katı madde olarak elde edilebilir. Suda çok iyi çözünür, ancak klorik asit veya bromik asidin aksine saf halde bulunur. İyodik asit +5 oksidasyon durumunda iyot içerir ve halojenlerin saf halde en stabil okso-asitlerinden biridir. İyot asidi dikkatle ısıtıldığında pentoksit iyice dehidre olur. Daha sonraki ısıtmada, iyot pentoksit ayrıca iyot, oksijen ve düşük iyot oksitleri karışımı vererek ayrışır.

Hidrojen bromür, HBr formülüne sahip iki atomlu moleküldür. Renksiz bir bileşik ve bir hidrojen halojenürdür. Hidrobromik asit, su içinde bir HBr çözeltisidir. Hem HBr'nin susuz hem de sulu çözeltileri, bromür bileşiklerinin hazırlanmasında ortak reaktiflerdir.

Kloröz asit, HClO2 formülüne sahip bir inorganik bileşiktir. Zayıf bir asittir. Klor, bu asitte +3 oksidasyon durumuna sahiptir. Saf madde dengesiz, hipokloröz aside (Cl oksidasyon hali + 1) ve klorik aside (Cl oksidasyon hali + 5) orantısızdır:
Hiponitröz asit, H2N2O2 veya HON=NOH formülüne sahip kimyasal bir bileşiktir. Bir nitramid, H2N−NO2 izomeridir.

Tellüröz asit, H2TeO3 formülüne sahip bir inorganik bileşiktir. Tellürün (IV) oksoasididir. Bileşik iyi karakterize edilmemiştir. Formülünü yazmanın alternatif bir yolu (HO)2TeO'dur. Prensip olarak, tellüröz asit, tellür dioksitin su ile, yani hidrolizle işlenmesiyle oluşacaktır. İlgili konjugat bazı, potasyum hidrojen tellürit (KHTeO3) gibi çeşitli tuzlar formunda iyi bilinmektedir.

Disülfürik asit veya pirosülfürik asit, kükürtün bir oksoasitidir. Oleumun önemli bir bileşenidir ve çoğu kimyager bu şekilde karşılaşır. Aynı zamanda, dengeye bağlı olarak sıvı susuz sülfürik asidin küçük bir bileşenidir:
- H2SO4 ⇌ H2O + SO3
- SO3 + H2SO4 ⇌ H2S2O7

Bromöz asit, HBrO2 formülüne sahip bir inorganik bileşiktir. Konjugat bazının -bromitlerinin- tuzları izole edilmiş olmasına rağmen, kararsız bir bileşiktir. Asidik çözeltide, bromitler broma ayrışır.
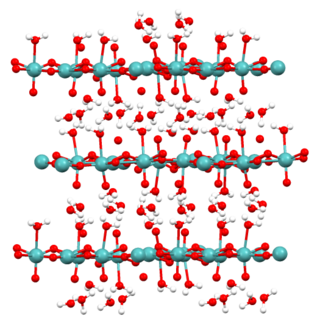
Molibdik asit, molibden trioksit ve ilgili türlerin hidratlanmış formlarını ifade eder. Monohidrat (MoO3·H2O) ve dihidrat (MoO3·2H2O) iyi karakterize edilir. Sarı diyamanyetik katılardır.
Hidrojen tellür (tellan), H2Te formülüne sahip bir inorganik bileşiktir. Bir hidrojen kalkojenür ve tellürün en basit hidrürü, renksiz bir gazdır. Ortam havasında kararsız olmasına rağmen, gaz çürümüş sarımsak benzeri kokusu tarafından son derece düşük konsantrasyonlarda kolayca tespit edilebilecek kadar uzun konsantrasyonlarda bulunabilir; ya da çürümüş pırasa benzeri biraz daha yüksek konsantrasyonlarda kokusu ile. Te–H bağları (tellüroller) olan bileşiklerin çoğu, H2 kaybı açısından kararsızdır. H2Te kimyasal ve yapısal olarak hidrojen selenüre benzer, her ikisi de asidiktir. H–Te–H açısı yaklaşık 90° 'dir. Uçucu tellür bileşikleri genellikle çürümüş pırasa veya sarımsak anımsatan hoş olmayan kokulara sahiptir.

Tellürik asit, Te(OH)6 formülüne sahip kimyasal bir bileşiktir. Sulu çözelti içinde devam eden oktahedral Te(OH)6 moleküllerinden oluşan beyaz bir katıdır. Rombohedral ve monoklinik olmak üzere iki formu vardır ve her ikisi de oktahedral Te(OH)6 molekülleri içerir. Tellürik asit, güçlü bazlara sahip tellürat tuzları ve zayıf bazlara sahip hidrojen tellürat tuzları veya sudaki tellüratların hidrolizi üzerine dibazik olan zayıf bir asittir.

















