Aromatiklik

Organik kimyada bazı atom halkalarının yapısı beklenenin üstünde kararlıdır. Doymamış bağlar, yalın elektron çiftleri veya boş orbitallerden oluşan konjüge bir halkanın konjüge olmasından beklenecek kararlılıktan daha yüksek bir kararlılık gösterme özelliğine aromatiklik (veya aromatisite) denir. Aromatiklik, halkasal delokalizasyon ve rezonansın bir belirtisi olarak da düşünülebilir.[1][2][3]
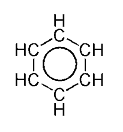
Aromatikliğin nedeni genelde, halkasal düzenlenmiş ve birbirlerine almaşık olarak tek ve çift bağlarla bağlı atomlar etrafında elektronların serbestçe dönebilmesine bağlanır. Bu bağlar birbirinin aynı olup her biri tek ve çift birer bağın birleşimi olarak düşünülebilir. Aromatik halkalar hakkındaki bu yaygın model, örneğin benzenin almaşık tek ve çift bağlardan oluşan altı kenarlı bir halka (sikloheksatrien) olduğu fikri, Kekulé tarafından geliştirilmiştir (bakınız aşağıda tarih kısmı). Benzen modeli iki rezonans biçiminden oluşmaktadır, bunlar çift ve tek bağların birbiriyle yer değiştirmesine karşılık gelir. Yüklerin delokalizasyonu göz önüne alınmazsa benzinin aslında olduğundan çok daha az kararlı olması beklenir.
Teori
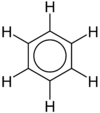
Rezonans diyagramlarında çift başlı ok, iki yapının ayrı varlıklar olmadığını, sadece birer olasılık olduğunu belirtir. Bu şekillerin hiçbiri asıl bileşiğin doğru bir temsili değildir, ikisinin hibriti (ortalaması) bileşiğin gerçek yapısını en iyi yansıtır. C=C bağı C-C bağından daha kısadır ama benzen molekülü tam bir altıgendir, altı karbon-karbon bağının her biri aynı uzunluğa sahiptir, bu uzunluk tek ve çift bağların uzunluğunun arasındadır.
Daha iyi bir betimleme, halkanın altında ve üstünde eşit bir sekilde dağılmış bir π-bağ ile elektron yoğunluğunun eşit bir şekilde dağılmış olduğu dairesel π bağlarıdır. Bu model, elektron yoğunluğunun aromatik halka içindeki dağılımını daha iyi betimler.
Karbon çekirdekleri arasındaki hayalî çizgi üzerinde bulunan elektronlar tarafından meydana gelen tek bağlara σ-bağları denir. Çift bağlar bir σ-bağı ve bir π-bağından oluşur. π-bağları, atomik p-orbitallarinin halka düzleminin altı ve üstünde örtüşmesinden meydana gelir. Aşağıdaki çizimler bu p-orbitallerinin konumlarını gösterir.

Atomların düzleminin dışında bulundukları için bu orbitaller birbirleriyle serbestçe etkileşebilir ve delokalize olabilir. Bu demektir ki, tek bir karbon atomuna bağlı olmak yerine, her bir elektron halkadaki altı atom tarafından paylaşılır. Dolayısıyla, her karbon atomu ile çift bağ kurmaya yetecek kadar elektron yoktur, ama "fazlalık" elektronlar halkadaki tüm bağları eşit derecede güçlendirirler. Meydana gelen moleküler orbitalde π simetrisi vardır.
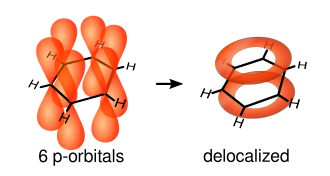
Tarih
Aromatik sözcüğünün kimyasal bir terim olarak ilk kullanımı, 1855'te August Wilhelm Hofmann tarafından yazılan, fenil radikali içeren bileşikler hakkında bir makalede olmuştur.[4] Aroma sözcüğünün kokular için kullanılan bir terim olduğu düşünülürse ve aromatik terimi gerçekten eğer ilk defa bu yayında kullanıldıysa, sadece bir kısmı kokulu olan bir grup bileşik için Hoffman'ın bu terimi bir sıfat olarak kullanmasının nedeni bilinmemektedir. En kokulu organik bileşikler terpenlerdir ve bunlar kimyasal anlamda aromatik değildir. Ama, terpen ve benzenoid bileşiklerin kimyasal bir ortak özelliği vardır, çoğu alifatik bileşikten daha yüksek bir doymamışlık endeksleri vardır. Hofmann bu iki kategori arasındaki ayrıma dikkat etmemiş olabilir.
Benzen için sikloheksatrien yapısı ilk defa August Kekulé tarafından 1865'te önerilmiştir. Bunu izleyen onyıllar zarfında çoğu kimyacı bu önerilen yapıyı kabul etmiştir, çünkü bu yapı aromatik kimyada bilinen çoğu izomerik ilişkileri açıklamaktaydı. Ancak, bu doymamış bileşiğin neden katılma reaksiyonlarında az tepkidiği anlaşılamayan bir olguydu.
Elektronun kaşifi J. J. Thomson, 1897 - 1906 arasında, benzendeki karbonlara arasında üç eşdeğer elektron olduğu görüşünü geliştirdi.
Benzenin istisnai kararlılığının bir açıklaması Robert Robinson'a atfedilir. Robinson, 1925'te ilk defa,[5] düzenlerinin bozulmasına direnç gösteren altı elektronlu gruplar için aromatik altılı terimini kullanmıştır.
Aslında bu teori daha eskiye, 1922'de Ernest Crocker[6] aracılığıyla Henry Edward Armstrong'a dayanır. Armstrong, 1890'da yayınladığı bir makalede "(altı) merkezcil afiniteler bir daire içinde etkir ... benzen bir çifte halka olarak tarif edilebilir ... ve katılmalı bir bileşik oluşunca iç afinite halkası bozulur, kendilerine bir şey eklenmeyen bitişik karbonlar zorunlu olarak etilenik hâle geçerler" demiştir.[7]
Burada Armstrong en az dört modern kavrama değinmektedir. Birincisi, "afinite" dediği şey günümüzdeki elektron olarak adlandırılır. konjugasyonu bozulan (ikinci kavram) bir Wheland ara ürünü yoluyla (üçüncü kavram) meydana gelen elektronik aromatik substitusyonu (dördüncü kavram) betimlemektedir . İç halkayı temsil etmek için halka üzerine C sembolünü kullanarak Eric Clar'ın notasyonuna öncülük etmiştir. Armstrong "afinite"lerin sadece noktasal tanecikler olmadıklarını, bir yönleri olduğunu da fark etmiş ve benzen halkasına sübstitüentler eklenmesinin "afinite"lerin dağılımının değiştirdiğini ifade etmiştir (bir cisimdeki elektrik yükün dağılımının başka bir cisim yaklaştırılmasıyla değişmesi gibi). Bu görüşleri ile dalga mekaniğinin temel kavramlarını öngörmüş olduğu da iddia edilmiştir.
Kararlılığın veya aromatikliğin, kuantum mekanik kökeni ilk defa 1931'de Hückel tarafından modellenmiştir. Bağ elektronlarını sigma ve pi elektronları olarak ayıran ilk kişi olmuştur.
Aromatik (aril) bileşikleri özellikleri
Aromatik (aril) bir bileşik belli özellikleri olan bir grup kovalent bağlı atom içerir:
- Genelde almaşık tek ve çift kovalent bağ düzeninden oluşmuş, Delokalize bir konjüge π sistemi.
- Sisteme ait tüm atomların aynı düzlemde olduğu eşdüzlemli bir yapı.
- Çift sayılı ama dördün katı olmayan sayıda delokalize π elektronları. Bu, Hückel kuralı olarak adlandırılır.
Benzenin aromatik (üç çift bağ için 6 elektron) olmasına karşın, siklobutadien değildir, çünkü delokalize elektron sayısı 4'tür ki bu tabii 4'ün bir katıdır. Siklobutadienür (-2) iyonu, oysa, aromatiktir (6 elektron). Aromatik bir sistemdeki bir atom, sisteme ait olmayan elektronlara sahip olabilir, bunlar 4n+2 kuralında için göz önüne alınmaz. Furan molekülündeki oksijen atomunda sp² hibridizasyonu vardır. Bir yalın çift π sistemine dahildir, öbürü ise halkanın düzlemi içindedir (diğer konumlardaki C-H bağına benzer şekilde). Altı π elektronu vardır, dolayısıyla furan aromatiktir.
Aromatik moleküller tipik olarak ileri derecede kimyasal stabilite (kararlılık) gösterirler, aromatik olmayan moleküllere kıyasla. Aromatik olabilen bir molekül, aromatik olabilmek için elektronik veya şekilsel (konformasyonel) yapısını değiştirir. Bu fazladan stabilite molekülün kimyasını değiştirir. Aromatik bileşikler elektrofilik aromatik substitusyona ve nükleofilik aromatik substitusyona uğrayabilirler, ama karbon-karbon çift bağlarında olan türden, elektrofilik ekleme tepkimeleri olmaz.
Aromatik bir molekülde dolaşan π elektronları halka akımları meydana getirir, bunlar dışarıdan uygulanan bir manyetik alana (NMR'de olduğu gibi) karşı kor. Aromatik halka düzlemindeki protonların NMR sinyali, aromatik olmayan sp² karbonlarınkine kıyasla daha düşük manyetik alan değerlerine doğru kayar. Bu, aromatikliği belirlemenin önemli bir yoludur. Aynı mekanizma ile halka ekseni üzerinde yer alan protonların sinyali daha yüksek alan değerlerine kayar.
Aromatik moleküller π-π istiflenmesi yoluyla birbirleriyle etkileşebilirler: π sistemleri "yüz-yüze" gelerek birbirleriyle örtüşürler. Aromatik moleküller ayrıca "yüz-kenara" da etkileşebilirler: halka atomlarındaki sübstitüentlerin üzerindeki ufak pozitif yük, öbür moleküldeki aromatik sistemdeki ufak negatif yük tarafından çekime uğrar.
4n sayıda π elektronu içeren düzlemsel tek halkalı moleküller antiaromatik olarak adlandırılır ve bunlar genelde kararsızdır. Antiaromatik olabilecek moleküller elektronik veya şekilsel (konformasyonel) yapılarını değiştirerek bu hâlde olmama, yani aromatik olmama, eğilimi gösterirler. Örneğin, siklooktatetraen düzlemsel yapısını bozarak bitişik çift bağlar arasındaki π örtüşmesini yok eder. Bir diğer örnek siklobutadien'dir; bu molekül asimetrik dikdörtgen bir yapı oluşturur, tek ve çift bağlar almaşık olmalarına rağmen tek bağlar çift bağlardan oldukça daha uzundur, bunun sonucu uygunsuz p-orbital örtüşmesi azalır. Dolayısıyla siklobutadien aromatik değildir; simetrik kare şekle etki edecek antiaromatik destabilizasyona kıyasla, asimetrik biçiminin gerginliği daha tercihlidir.
Aromatik bileşiklerin önemi
Aromatik bileşikler endüstride önemli yere sahiptir. Hidrokarbonların en önemlileri arasında benzen, toluen, orto-ksilen ve para-ksilen sayılabilir. Dünya çapında her yıl yaklaşık 35 milyon ton aromatik bileşik üretilir. Petrol rafinasyonu veya kömür katranının damıtımı ile Karmaşık karışımlardan elde edilirler. Bu bileşiklerden stiren, fenol, anilin, polyester ve naylon gibi önemli kimyasallar ve polimerler üretilir.
Başka aromatik bileşikler tüm canlıların biyokimyasında anahtar rollere sahiptir. Proteinleri oluşturan 20 amino asitten üçü, fenilalanin, triptofan ve tirozin, aromatiktir. Ayrıca, DNA ve RNA'ki nükleotitler (adenin, timin, sitozin, guanin, urasil) aromatik pürin ve pirimidin türevleridir. Hem grubu 22 π elektronundan oluşan bir aromatik sistem içerir, klorofilde de benzer bir aromatik sistem vardır.
Aromatik bileşik tipleri
Aromatik bileşiklerin çok büyük çoğunluğu karbon içerir ama hidrokarbon olmak zorunda değildirler.
Hetrosiklikler
Heterosiklik aromatiklerde (heteroaromatlar), aromatik halkanın bir veya daha fazla atomu karbondan başka elementtir. Bu durum halkanın aromatikliğini azaltabilir ve dolayısıyla (furan molekülünde olduğu gibi) reaktivitesini artırır. Başka örnekler arasında piridin, pirazin, imidazol, pirazol, oksazol, tiyofen ve bunların benzen eklemeli türevleri (örneğin benzimidazol) sayılabilir.
Polisiklikler
Polisiklik aromatik hidrokarbonlar, bitişik iki komşu karbonun paylaşılması sonucu birbiriyle kaynaşmış iki veya daha çok basit aromatik halkadan oluşur. Örnek olarak naftalen, antrasen ve fenantren sayılabilir.
Sübstitüent aromatikler
Çoğu kimyasal bileşikteki aromatik halkaya başka şeyler eklidir. Örnek olarak trinitrotolüen (TNT), asetilsalisilik asit (aspirin), parasetamol ve DNA'daki nükleotitler gösterilebilir.
Atipik aromatik bileşikler
Aromatiklik iyonlarda da görülebilir: siklopropenil katyonu (2e sistem), siklopentandienil anyonu (6 e sistem), tropilyum iyonu (6e) ve siklooktatetraen dianyonu (10e). Tropon gibi non-benzenoid bileşiklerin aromatik özellikler olduğu öne sürülmüştür. Siklofanlar olarak adlandırılan bir bileşikler sınıfında aromatik özellikler sınırda görülür.
Homoaromatiklikte aromatiklikliğin özel bir hâli görülür, bunda tek bir sp³ hibritleşmiş karbon atomu konjügasyonu bozmuştur. Benzendeki karbon yerine başka bir element gelince, örneğin borabenzen, silabenzen, germanobenzen, stannabenzen, fosforin veya pirilyum tuzlarında olduğu gibi, aromatiklik korunur.
Aromatiklik karbondan oluşmayan bileşiklerde de görülür. Benzene benzer inorganik 6 üyeli halkalı bileşikler sentezlenmiştir. Silikazin (Si6H6) ve borazin (B3N3H6) yapısal olarak benzene benzerdir, benzendeki karbon atomlarının yerini başka elementler almıştır. Borazinde boron ve azot atomları halka etrafında almaşırlar.
Metal aromatikliğinin alüminyumun bazı metal kümelerinde bulunduğu düşünülmektedir. Möbius aromatikliği, Möbius şeridine benzer şekilde, bazı halkasal moleküler orbital sistemlerinin bir yarım burgu içermesinde görülür. Bu sistemler pπ atomik orbitallerinden oluşur ve 4n sayıda elektron içeren kapalı yörüngeleri vardır. Burgu sol-elli veya sağ elli olabileceği için meydana gelen Möbius aromatikleri dissimetrik veya kiral olur.
Kaynakça
- ^ Schleyer, P. v. R. (2001). "Aromaticity (Editorial)". Chemical Reviews. Cilt 101. ss. 1115-1118..
- ^ Balaban,A. T., Schleyer, P. v. R., Rzepa, H. S. (2005). "Crocker, Not Armit and Robinson, Begat the Six Aromatic Electrons". Chemical Reviews. Cilt 105. ss. 3436-3447.
- ^ Schleyer, P. v. R. (2005). "Introduction: Delocalization-π and σ (Editorial)". Chemical Reviews. Cilt 105. ss. 3433-3435..
- ^ Hofmann,A.W. (1855). "On Insolinic Acid". Proceedings of the Royal Society. Cilt 8. ss. 1-3.
- ^ Armit, J.W., Robinson R. (1925). "CCXI.—Polynuclear heterocyclic aromatic types. Part II. Some anhydronium bases". Journal of the Chemical Society, Transactions. Cilt 127. ss. 1604-1618. 27 Mayıs 2020 tarihinde kaynağından arşivlendi. Erişim tarihi: 21 Mayıs 2010.
- ^ Ernest C. Crocker (1922). "Application of the Octet Theory to Single-Ring Aromatic Compounds". J. Am. Chem. Soc. Cilt 44. ss. 1618-1630. 27 Mayıs 2020 tarihinde kaynağından arşivlendi. Erişim tarihi: 21 Mayıs 2010.
- ^ Armstrong, H.E. (1890). "The structure of cycloid hydrocarbons". Proceedings of the Chemical Society. Cilt 6. Londra. ss. 95 - 106. 16 Ekim 2019 tarihinde kaynağından arşivlendi. Erişim tarihi: 21 Mayıs 2010.