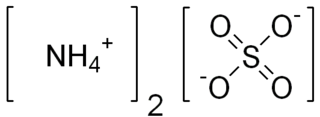Amonyum klorür
 | |
 | |
| Adlandırmalar | |
|---|---|
Amonyum klorür | |
Diğer adlar Nişadır | |
| Tanımlayıcılar | |
CAS numarası | |
3D model (JSmol) | |
| ChEBI | |
| ChemSpider | |
| ECHA InfoCard | 100.031.976 |
| EC Numarası |
|
| KEGG | |
| RTECS numarası |
|
| UNII | |
CompTox Bilgi Panosu (EPA) | |
| |
| |
| Özellikler | |
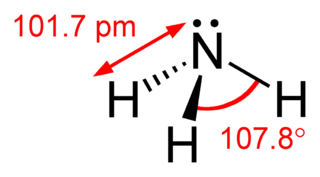
| Kimyasal formül | H4ClN |
| Molekül kütlesi | 53,49 g mol−1 |
| Görünüm | Beyaz katı, higroskopik |
| Koku | Kokusuz |
| Yoğunluk | 1.5274 gr/cm3[2] |
| Erime noktası | 338 °C süblime olur, bozunur |
| Kaynama noktası | 520 °C |
| 337.6 °C2de süblime olur[4] ΔsublH | |
| Çözünürlük (su içinde) | 244 gr/L (−15 °C) 294 gr/L (0 °C) 283.0 gr/L (25 °C) 454.4 gr/L (40 °C) 740.8 gr/L (100 °C)[3] |
Çözünürlük ürünü (Ksp) | 30.9 (395 gr/L)[1] |
| Çözünürlük | amonyak, hidrazin, alkol, metanol, gliserinde çözünür asetonda çok az çözünür dietil eter, etil asetatda çözünmez[4] |
| Çözünürlük (metanol içinde) | 3.2 gr/100 g (17 °C) 3.35 gr/100 g (19 °C) 3.54 gr/100 g (25 °C)[4] |
| Çözünürlük (etanol içinde) | 6 gr/L (19 °C)[2] |
| Çözünürlük (gliserin içinde) | 97 gr/kg[4] |
| Çözünürlük (kükürt dioksit içinde) | 0.09 gr/kg (0 °C) 0.031 gr/kg (25 °C)[4] |
| Çözünürlük (asetik asit içinde) | 0.67 g/kg (16.6 °C)[4] |
| Buhar basıncı | 133.3 Pa (160.4 °C)[5] 6.5 kPa (250 °C) 33.5 kPa (300 °C)[2] |
| Asitlik (pKa) | 9.24 |
| Kırınım dizimi (nD) | 1.642 (20 °C)[4] |
| Termokimya | |
Isı sığası (C) | 84.1 J/mol•K[2] |
Standart molar entropi (S⦵298) | 94.56 J/mol•K[2] |
Standart formasyon entalpisi (ΔfH⦵298) | −314.43 kJ/mol[2] |
Gibbs serbest enerjisi (ΔfG⦵) | −202.97 kJ/mol[2] |
| Tehlikeler | |
| GHS etiketleme sistemi: | |
| Piktogramlar |  [5] [5] |
| İşaret sözcüğü | Uyarı |
| R-ibareleri | R22, R36 |
| G-ibareleri | S2, S22 |
| Tehlike ifadeleri | H302, H319[5] |
| Önlem ifadeleri | P305+P351+P338[5] |
| NFPA 704 (yangın karosu) | |
| Parlama noktası | Yanıcı değildir |
| Öldürücü doz veya konsantrasyon (LD, LC): | |
LD50 (medyan doz) | 1650 mg/kg (sıçan, oral) |
| NIOSH ABD maruz kalma limitleri: | |
| PEL (izin verilen) | yok[7] |
| REL (tavsiye edilen) | TWA 10 mg/m3 ST 20 mg/m3 (duman olarak)[7] |
| IDLH (anında tehlike) | N.D.[7] |
| AB sınıflandırması | Hazchem Xn Hazchem Xi |
| Güvenlik bilgi formu (SDS) | ICSC 1051 |
| Benzeyen bileşikler | |
Diğer anyonlar | Amonyum florür Amonyum bromür Amonyum iyodür |
Diğer katyonlar | Sodyum klorür Potasyum klorür Hidroksilamonyum klorür |
| Aksi belirtilmediği sürece madde verileri, Standart sıcaklık ve basınç koşullarında belirtilir (25 °C [77 °F], 100 kPa). | |
Amonyum klorür ya da daha çok bilinen adıyla Nişadır, formülü NH4Cl olan bir kimyasal bileşiktir. Suda yüksek oranda çözünen, beyaz kristallere sahip bir tuzdur. Amonyum klorür çözeltileri hafif asidiktir. Doğada mineral halde bazı volkan bacalarının etrafında bulunan haline sal amonyak denir. Bazı tür meyan ballarında bir aroma maddesi olarak kullanılır. Nişadır, hidroklorik asit ve amonyak arasında gerçekleşen reaksiyonla sonucu oluşur.
Elde etme
Nişadır, Sodyum karbonat üretmek için kullanılan solvay işleminin bir ürünü olarak ortaya çıkar:[6]
- CO2 + 2 NH3 + 2 NaCl + H2O → 2 NH4Cl + Na2CO3
Bu yöntem yalnızca nişadır üretimi için temel yöntem olmakla kalmaz, aynı zamanda bazı endüstriyel işlemlerde amonyak salınımını en aza indirmek için de kullanılır.
Amonyum klorür ticari olarak amonyak (NH3)'un hidrojen klorür (gaz) veya hidroklorik asit (su çözeltisi) ile birleştirilmesiyle hazırlanır:
- NH3 + HCl → NH4Cl
Amonyum klorür, volkanik bölgelerde doğal olarak da oluşur ve duman salan deliklerin (fümerol) yakınındaki volkanik kayalar üzerinde oluşur. Kristaller doğrudan gaz halinde birikir ve suda kolaylıkla çözündükleri için kısa ömürlü olma eğilimindedirler. Doğada mineral halinde bulunan amonyum klorüre sal amonyak adı verilir.[8]
Reaksiyon

Amonyum klorür ısıtıldığında süblim görünür, ancak gerçekte geri dönüşümlü olarak ayrışarak amonyak ve hidrojen klorür gazına dönüşür:[6]
- NH4Cl
 NH3 + HCl
NH3 + HCl
Amonyum klorür, amonyak gazı açığa çıkarmak için sodyum hidroksit gibi güçlü bir bazla reaksiyona girer:
- NH4Cl + NaOH → NH3 + NaCl + H2O
Benzer şekilde, amonyum klorür de yüksek sıcaklıklarda alkali metal karbonatlarla reaksiyona girerek amonyak ve alkali metal klorür verir:
- 2 NH4Cl + Na2CO3 → 2 NaCl + CO2 + H2 O + 2 NH3
Sudaki kütlece %5 amonyum klorür çözeltisinin pH değeri 4,6 ila 6,0 aralığındadır.[9]
Amonyum klorürün diğer kimyasallarla olan bazı reaksiyonları, örneğin baryum hidroksit ile reaksiyonu ve suda çözünmesi gibi, endotermiktir.
Kullanım alanları

Amonyum klorürün baskın uygulaması, kloroamonyum fosfat gibi gübrelerde (dünya amonyum klorür üretiminin %90'ına karşılık gelir) bir nitrojen kaynağı olarak kullanılır. Bu şekilde döllenen ana mahsullar, Asya'daki pirinç ve buğday'dır.[10]
18. yüzyılda piroteknikte amonyum klorür kullanılmış ancak yerini daha güvenli ve daha az higroskopik kimyasallar almıştır. Amacı, alevdeki bakır iyonlarından yeşil ve mavi renkleri zenginleştirecek bir klor donörü sağlamaktı.
Beyaz duman sağlamak için ikincil bir kullanımı vardı, ancak son derece kararsız amonyum klorat üreten potasyum klorat ile hazır çift ayrışma reaksiyonu, kullanımını çok tehlikeli hale getirdi.[11][12][13]
Metal işleri
Nişadır, kalay kaplanacak, galvanizlenecek veya lehimlenecek metallerin hazırlanmasında "flux" olarak kullanılır. Uçucu bir metal klorür oluşturmak için yüzeydeki metal oksitlerle reaksiyona girerek iş parçalarının yüzeyini temizleyerek bir akı olarak çalışır. Bu amaçla, bir havya ucunun temizlenmesinde kullanılmak üzere hırdavatçılarda bloklar halinde satılır ve ayrıca lehime flaks olarak da katılabilir.
Tıp
Amonyum klorür öksürük ilaçlarında balgam söktürücü olarak kullanılır. Balgam söktürücü etkisi, bronşiyal mukoza üzerindeki tahriş edici etkiden kaynaklanır, bu da muhtemelen öksürmeyi kolaylaştıran aşırı solunum yolu sıvısının üretilmesine neden olur. Amonyum tuzları mide mukozası için tahriş edicidir, bunun sonucunda bulantı ve kusmaya neden olabilir.
Amonyum klorür, şiddetli metabolik alkaloz tedavisinde, distal renal tübüler asidozu teşhis etmek için oral asit yükleme testinde, bazı idrar yolu bozukluklarının tedavisinde idrarın pH'ını asit seviyesinde tutmak için sistemik bir asitleştirici ajan olarak kullanılır.[]
Gıda
Amonyum klorür, sal amonyak veya salmiak adı altında E numarası koduyla gıda katkı maddesi olarak kullanılır. E510, ekmek yapımında maya besleyici ve asitleştirici olarak kullanılır.[14] Sığırlar için bir yem takviyesi; mayalar ve birçok mikroorganizma için besleyici ortamda bir bileşendir.
Amonyum klorür, tuzlu meyankökü (İskandinav ülkeleri, Benelüks ve kuzey Almanya'da popüler) adı verilen koyu renkli tatlıları tatlandırmak için kullanılır,[15] kurabiyelere çok gevrek bir doku vermek için fırıncılıkta ve tatlandırmak için Salmiakki Koskenkorva liköründe de kullanılır. İran, Tacikistan, Hindistan, Pakistan ve Arap ülkelerinde "noshader" olarak adlandırılır ve samosas ve jalebi gibi atıştırmalıkların gevrekliğini artırmak için kullanılır.
Türkiye'de daha çok piyasa adıyla nişadır olarak bilinir.
Laboratuvarda kullanım
Amonyum klorür tarihsel olarak soğutma banyolarında düşük sıcaklıklar üretmek için kullanılmıştır.[16]
Amonyak içeren amonyum klorür çözeltileri, ACK (Amonyum-Klorür-Potasyum) lizis tamponu dahil olmak üzere tampon çözelti olarak kullanılır.[17]
Paleontolojide, amonyum klorür buharı fosillerin üzerine depoze edilir, burada madde parlak beyaz, kolayca çıkarılabilen ve fosilin sahip olabileceği herhangi bir renklenmeyi örten küçük kristallerden oluşan oldukça zararsız ve inert bir tabaka oluşturur ve bir açıyla aydınlatılırsa üç boyutlu örneklerin fotoğrafik dokümantasyonunda kontrastı oldukça artırır.[18] Aynı teknik arkeolojide fotoğrafçılıkta cam ve benzeri numuneler üzerindeki yansımayı ortadan kaldırmak için uygulanmaktadır.[19]
Organik sentezde doymuş NH4Cl çözeltisi tipik olarak reaksiyon karışımlarını söndürmek için kullanılır.[20]
242,8 binde ve sıfır basınçta lambda geçişi ("λ" yoğun madde fiziğinde bir grup olan evrensellik sınıfıdır) olur.[21]
Ayrıca bakınız
- Doğada mineral halde bulunan sal amonyak
Kaynakça
- ^ "Solubility Products of Selected Compounds". www.saltlakemetals.com. Salt Lake Metals. 21 Ekim 2015 tarihinde kaynağından arşivlendi. Erişim tarihi: 11 Haziran 2014.
- ^ a b c d e f g Pradyot, Patnaik (2003). Handbook of Inorganic Chemicals. The McGraw-Hill Companies, Inc. ISBN 0-07-049439-8.
- ^ Seidell, Atherton; Linke, William F. (1919). Solubilities of Inorganic and Organic Compounds (2. bas.). D. Van Nostrand Company.
Results here are multiplied by water's density at temperature of solution for unit conversion. - ^ a b c d e f g "Arşivlenmiş kopya". 23 Temmuz 2015 tarihinde kaynağından arşivlendi. Erişim tarihi: 26 Eylül 2015.
- ^ a b c d Sigma-Aldrich Co., Ammonium chloride. Retrieved on 11 Haziran 2014.
- ^ a b c Wiberg, Egon; Wiberg, Nils (2001). Anorganik Kimya (resimli bas.). Academic Press. s. 614. ISBN 978-0-12-352651-9. 21 Aralık 2016 tarihinde kaynağından arşivlendi. Erişim tarihi: 2 Kasım 2016.
- ^ a b c NIOSH Pocket Guide to Chemical Hazards. "#0029". National Institute for Occupational Safety and Health (NIOSH).
- ^ Rowley, Steven P. (2011). General Chemistry I Laboratory Manual (Second bas.). Kendall Hunt. ISBN 978-0-7575-8942-3.
- ^ Bothara, K. G. (2008). İnorganik Farmasötik Kimya. Pragati Books Pvt. s. 13. ISBN 978-81-85790-05-3. 22 Aralık 2016 tarihinde kaynağından arşivlendi. Erişim tarihi: 2 Kasım 2016.
- ^ Zapp, Karl-Heinz (2012) Ullmann's Encyclopedia'daki "Amonyum Bileşikleri" Endüstriyel Kimya. Wiley-VCH, Weinheim. DOI:10.1002/14356007.a02_243
- ^ Conkling, John A.; Mocella, Christopher J. (2010). Piroteknik Kimyası (2.2yayıncı=CRC Press bas.). ISBN 978-1574447408.
- ^ Davis, Tenney L (2012). Barut ve Patlayıcıların Kimyası. Angriff Press. ISBN 978-0945001171.
- ^ Kosanke, K.L.; Kosanke, B.J.; Sturman, Barry T.; Winokur, Robert M. (2012). Ansiklopedik Piroteknik Sözlüğü (ve İlgili Konular). Journal of Pyrotechnics. ISBN 978-1889526195.
- ^ {{kitap kaynağı|soyadı1=Smith|ad1=Jim|soyadı2=Hong-Shum|ad2=Lily|başlık =Food Additives Data Book|yıl=2011|yayıncı=John Wiley & Sons|isbn=978-1444397734|sayfa=540|basım=2.2
- ^ Christine S. (8 Ağustos 2011). "In Salmiak Territory". The Harvard Crimson. 12 Eylül 2017 tarihinde kaynağından arşivlendi. Erişim tarihi: 8 Ağustos 2017.
- ^ "A New Frigorifick Experiment Shewing, How a Considerable Degree of Cold Can Be Suddenly Produced without the Help of Snow, Ice, Haile, Wind, or Niter, and That at Any Time of the Year". Philosophical Transactions. 1 (15): 255-261. 18 Temmuz 1666. doi:10.1098/rstl.1665.0106.
- ^ "ACK Lysis Buffer". Cshprotocols.cshlp.org. 1 Kasım 2014. 11 Ağustos 2020 tarihinde kaynağından arşivlendi. Erişim tarihi: 23 Ocak 2018.
- ^ Marsh, L. F. and Marsh, R. C. (1975). "Paleontolojik örneklerin fotoğraflanmadan önce kaplanması için yeni teknikler". Journal of Paleontology. 49 (3): 565-566. 16 Nisan 2016 tarihinde kaynağından arşivlendi. Erişim tarihi: 17 Aralık 2012.
- ^ "Home - BCIN". Bcin.ca. 1 Ağustos 2017. 16 Mayıs 2013 tarihinde kaynağından arşivlendi. Erişim tarihi: 23 Ocak 2018.
- ^ Robert K. Boeckman, Jr.; Douglas J. Tusch; Kyle F. Biegasiewicz (2015). "(S)-1,1-Diphenylprolinol Trimethylsilyl Ether". Org. Synth. 92: 309-319. doi:10.15227/orgsyn.092.0309.
- ^ Pippard, A. B. (Mayıs 1956). "XLVIII. Lambda geçişi yakınında geçerli termodinamik ilişkiler". Philosophical Magazine. 1 (5): 473-476. Bibcode:1956PMag....1..473P. doi:10.1080/14786435608238127. ISSN 0031-8086.