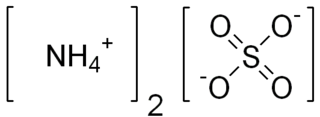Sodyum, periyodik cetvelde Na simgesi ile gösterilen ve atom numarası 11 olan element. Sodyum yumuşak ve kaygan bir metal olup alkali metaller grubuna aittir. Doğal bileşiklerin içinde bol miktarda bulunur. Yüksek oranda reaktiftir, sarı bir alevle yanar, su ile şiddetli reaksiyon verir ve havada hızla oksitlenir. Dolayısıyla, vazelin, gazyağı gibi hava ve su ile temasını kesecek bir ortamda saklanması gerekir.

Azot ya da nitrojen, simgesi N olan bir element olup atom numarası 7'dir. Renksiz, kokusuz, tatsız ve inert bir gazdır. Azot, dünya atmosferinin yaklaşık %78'ini oluşturur ve tüm canlı dokularında bulunur. Azot ayrıca, amino asit, amonyak, nitrik asit ve siyanür gibi önemli bileşikler de oluşturur.

Patlayıcı madde, hararet veya şok tesiri ile kimyasal değişikliğe uğrayan, yüksek derecede ısı, çok hacimde gaz meydana getiren, katı, sıvı veya gaz hâlindeki kimyasal maddelerdir.

Krom, atom numarası 24, atom ağırlığı 51,996 olan metalik bir elementtir. İsmi Yunanca renk anlamına gelen "kroma"dan gelmektedir. Parlak ve yansıtıcı özelliğe sahiptir.
İnorganik kimya veya anorganik kimya; organik olmayan, yani karbon-hidrojen bağı içermeyen bileşiklerin özelliklerini ve kimyasal davranışlarını inceleyen kimya dalı. Anorganik ve organik kimyayı birleştiren organometalik bileşikler, organometalik kimya adında başka bir dalı oluşturur.

Grena, garnet veya granat, başkalaşmış kayaçlarda ve bazı yerli kayaçlarda bulunan doğal silikat grubudur. Grena (süleyman taşı ya da "lal taşı" da denir) grubunun yerel formülü X3Y2(SiO4)3'tür. Formülde X iki değerli katyonu (demir, magnezyum, kalsiyum ya da manganez), Y üç değerli katyonu (alüminyum, demir ya da krom), SiO4 de dört oksijen iyonuyla çevrili silikat iyonunu gösterir.

Aminler, amonyaktaki bir veya daha fazla hidrojen atomunun organik radikaller ile değiştirilmesi yöntemiyle türetilmiş organik bileşikler ve fonksiyonel gruplardır. Yapısal olarak aminler amonyağa benzerler, ama bir veya daha fazla hidrojen atomu, alkil veya aril gibi organik sübstitüentlerle yer değiştirmiştir. Bu kuralın önemli bir istisnası RC(O)NR2 tipi bileşiklerdir (C(O) karbonil grubuna karşılık gelir), bunlara amin yerine amid denir. Amidler ve aminlerin yapıları ve özellikleri farklı olduğu için bu ayrım kimyasal olarak önemlidir. Adlandırma açısında biraz akıl karıştırıcı olan bir nokta, bir aminin N-H grubunun N-M (M= metal) ile değişmesi hâlinde buna da amid denmesidir. Örneğin (CH3)2NLi, lityum dimetilamid'dir.

İnorganik, organik olmayan anlamına gelir. Biyolojide su, mineral, asit, baz, tuzlar gibi canlıların yapısında bulunan ancak canlı olmayan veya bir canlı tarafından üretilmemiş bileşiklerdir. Kimyada inorganik bileşikler, sıklıkla karbon taşımayan moleküllerdir. Bunlara örnek olarak da, anyonlar veya katyonlar olarak sınıflandırılan çeşitli iyonik bileşikler ile kovalent bileşikleri verilebilir. Birçoğu iyonlardan meydana gelmiş olsa da kovalent bağlı inorganik bileşikler de bulunur. Karbon disülfür, karbonmonoksit ve siyanürler gibi karbon bileşikleri inorganik olarak kabul edilir.

Henri Moissan, Yahudi kökenli Fransız eczacı ve kimyagerdir.

Hidroksit, kimya biliminde, oksijen ve hidrojen atomları içeren diatomik anyonun adıdır. Genellikle bir bazın parçalanması sonucu ortaya çıkar. Bilinen en basit diatomik iyonlardan biridir.
Krom nitrür, CrN formülüne sahip krom ve azotun kimyasal bir bileşiğidir. Çok serttir ve korozyona karşı son derece dayanıklıdır. Azot atomlarının krom kafesteki oktahedral delikleri işgal ettiği bir interstisyel bileşiktir: bu nedenle, kesinlikle bir krom (III) bileşiği değildir ve nitrür iyonları (N3-) içermez. Krom ikinci bir interstisyel nitrür, dikrom nitrür, Cr2N oluşturur.
Amonyum nitrat, amonyum ve nitrat iyonlarından oluşan, NH4NO3 formülüne sahip yüksek patlayıcı bir kimyasal bileşiktir. Higroskopik özellikte ve beyaz kristal bir katı olarak hidrat oluşturmasa da suda çok çözünür. Ağırlıklı olarak, tarımda yüksek azotlu gübre olarak kullanılmaktadır. 2017 yılında küresel üretimi 21.6 milyon ton olarak tahmin edildi.
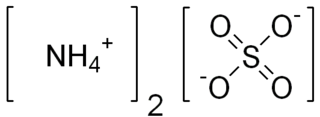
Amonyum sülfat, (NH4)2SO4 formülüne ve çok sayıda ticari kullanıma sahip bir inorganik tuzdur. Toprak gübresi olarak yaygın bir şekilde kullanılır. %21 azot ve %24 kükürt içerir.

Yükseltgen madde bir yükseltgenme-indirgenme (redoks) reaksiyonunda başka bir türden bir elektron alan element ya da bileşiktir. Yükseltgen maddelerin elektron kazandıklarından dolayı indirgendikleri söylenebilir.

Hekzavalent krom (krom (VI), Cr (VI), krom 6, altı değerlikli krom), +6 oksidasyon durumunda (yani hekzavalent) krom elementini içeren herhangi bir kimyasal bileşik. Neredeyse tüm krom cevheri, özellikle de sodyum dikromat tuzu altı değerlikli krom ile işlenir. 1985 yılında yaklaşık 136.000 ton (300.000.000 lb) hekzavalent krom bileşiği üretildi. Diğer hekzavalent krom bileşikleri arasında krom trioksit ve çeşitli kromat ve dikromat tuzları vardır. Hekzavalent kromdan, tekstil boyalarında, ahşabın korunmasında, korozyon önleyici ürünlerde, kromat dönüşüm kaplamalarında ve çeşitli niş kullanımlarında faydalanılınır. Hekzavalent krom bileşiklerinin endüstriyel kullanımları, mürekkepler, plastikler ve boyalardaki kromat pigmentlerini, astarlara ve diğer yüzey kaplamalarına antikorozif maddeler olarak eklenen kromatları; ve dekoratif veya koruyucu bir kaplama sağlamak için metal parçalar üzerine elektrolizle kaplanmış kromik asiti içerir. Paslanmaz çelik üretiminde ve kromun eritilmesinde olduğu gibi "sıcak işler" yapılırken krom normalde 6 değerlikli halde bulunmamasına karşın yüksek sıcaklıktan dolayı altı değerli kroma dönüşüm gerçekleşir. Hekzavalent krom ayrıca içme suyunda ve kamu su sistemlerinde bulunabilir.

Sodyum kromat Na2CrO4 formülüne sahip bir inorganik bileşiktir. Tetra-, hekza- ve dekahidratlar oluşturabilen sarı higroskopik bir katı olarak bulunur. Cevherlerinden krom özütlemesinde bir ara maddedir.

Mangan(II) nitrat Mn(NO3)2•(H2O)n formülüne sahip bir inorganik bileşiktir. Her formül birimi bir Mn2+ katyon ve iki NO3− anyonu ile değişen miktarlarda sudan oluşur. En yaygın olanı tetrahidrat Mn(NO3)2•4H2O dır. Fakat, susuz bileşiğin yanı sıra mono ve hekzahidratlar da bilinmektedir. Bu bileşiklerin bazıları, mangan oksitleri için faydalı öncül maddelerdir.

Sodyum bikromat Na2Cr2O7 formülüne sahip bir inorganik bileşiktir. Ancak, genellikle tuz dihidrat Na2Cr2O7•2H2O olarak kullanılır. Neredeyse tüm krom cevheri, sodyum bikromata dönüştürülerek işlenir ve neredeyse krom bazlı bütün bileşikler ve maddeler bu tuzdan hazırlanır. Reaktivite ve görünüm açısından, sodyum bikromat ve potasyum bikromat çok benzerdir. Bununla birlikte sodyum tuzu, suda potasyum tuzundan yaklaşık yirmi kat daha fazla çözünür(0 °C’de 49 g/L) ve eşdeğer ağırlığı da daha düşüktür ki bu da genellikle istenen bir durumdur.
Kromik asit terimi genellikle, katı krom trioksit de dahil olmak üzere çeşitli bileşikler içerebilen bir dikromata konsantre sülfürik asit eklenerek yapılan bir karışım için kullanılır. Bu tür kromik asit, cam için bir temizleme karışımı olarak kullanılabilir. Kromik asit ayrıca trioksitin anhidrit olduğu H2CrO4 moleküler türlerine de atıfta bulunabilir. Kromik asit, +6 (veya VI) oksidasyon durumunda krom içerir. Güçlü ve aşındırıcı bir oksitleyici ajandır.
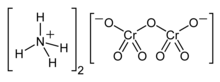
Potasyum dikromat, K
2Cr
2O
7, çeşitli laboratuvar ve endüstriyel uygulamalarda en yaygın olarak oksitleyici madde olarak kullanılan yaygın bir inorganik kimyasal reaktiftir. Tüm altı değerlikli krom bileşiklerinde olduğu gibi sağlığa akut ve kronik olarak zararlıdır. Çok parlak, kırmızı-turuncu renge sahip kristal iyonik bir katıdır. Bu tuz, endüstriyel açıdan daha uygun olan sodyum dikromat tuzunun aksine, nemden arındırılmadığı için laboratuvarlarda popülerdir.







 [1]
[1]