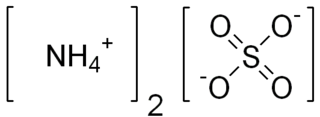Amino asitler, proteinleri oluşturan temel yapı taşlarıdır.

Gübre, bitkinin beslenmesinde gerekli olan kimyasal elementleri sağlamak için toprağa ilave edilen herhangi bir madde.

Asit, pH derecesi 7'den düşük olup, değişen oranlarda yakıcı ve/veya aşındırıcı özelliğe sahip olan ve oldukça geniş kullanım alanına sahip kimyasal maddelere verilen isimdir. Suda çözündüklerinde hidrojen iyonu derişimini artırarak çözeltiyi asidik yapar. Mavi turnusol kâğıdının rengini kırmızıya çeviren asitlere eski Türkçede hamız veya ekşit denir.

Azot ya da nitrojen, simgesi N olan bir element olup atom numarası 7'dir. Renksiz, kokusuz, tatsız ve inert bir gazdır. Azot, dünya atmosferinin yaklaşık %78'ini oluşturur ve tüm canlı dokularında bulunur. Azot ayrıca, amino asit, amonyak, nitrik asit ve siyanür gibi önemli bileşikler de oluşturur.
İnorganik kimya veya anorganik kimya; organik olmayan, yani karbon-hidrojen bağı içermeyen bileşiklerin özelliklerini ve kimyasal davranışlarını inceleyen kimya dalı. Anorganik ve organik kimyayı birleştiren organometalik bileşikler, organometalik kimya adında başka bir dalı oluşturur.

Asit yağmuru, asidik kimyasalların yağmur, kar, sis, çiy veya kuru parçacıklar hâlinde yeryüzüne düşmesine verilen isimdir.

Aminler, amonyaktaki bir veya daha fazla hidrojen atomunun organik radikaller ile değiştirilmesi yöntemiyle türetilmiş organik bileşikler ve fonksiyonel gruplardır. Yapısal olarak aminler amonyağa benzerler, ama bir veya daha fazla hidrojen atomu, alkil veya aril gibi organik sübstitüentlerle yer değiştirmiştir. Bu kuralın önemli bir istisnası RC(O)NR2 tipi bileşiklerdir (C(O) karbonil grubuna karşılık gelir), bunlara amin yerine amid denir. Amidler ve aminlerin yapıları ve özellikleri farklı olduğu için bu ayrım kimyasal olarak önemlidir. Adlandırma açısında biraz akıl karıştırıcı olan bir nokta, bir aminin N-H grubunun N-M (M= metal) ile değişmesi hâlinde buna da amid denmesidir. Örneğin (CH3)2NLi, lityum dimetilamid'dir.

Sülfürik(VI) asit ya da halk arasında bilinen ismi ile zaç yağı, H2SO4, güçlü bir mineral asididir. Olası kâşifi 8. yüzyıl simyacısı Cabir bin Hayyan tarafından yenime uğratıcı, renksiz ve yoğunluğu yüksek sıvı olarak tanımlanmıştır. Suda her konsantrasyonda çözünebilir. Büyük ölçüde korozif oluşu, güçlü asidik yapısından ve dehidrasyon özelliğinden kaynaklanmaktadır.
Amonyum nitrat, amonyum ve nitrat iyonlarından oluşan, NH4NO3 formülüne sahip yüksek patlayıcı bir kimyasal bileşiktir. Higroskopik özellikte ve beyaz kristal bir katı olarak hidrat oluşturmasa da suda çok çözünür. Ağırlıklı olarak, tarımda yüksek azotlu gübre olarak kullanılmaktadır. 2017 yılında küresel üretimi 21.6 milyon ton olarak tahmin edildi.
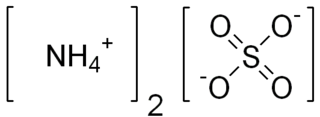
Amonyum sülfat, (NH4)2SO4 formülüne ve çok sayıda ticari kullanıma sahip bir inorganik tuzdur. Toprak gübresi olarak yaygın bir şekilde kullanılır. %21 azot ve %24 kükürt içerir.

Metil Metakrilat (MMA), CH
2C(CH
3)COOCH
3 formüllü organik bileşik. Metakrilik asitin Metil esteridir. Renksiz, yanıcı bir sıvıdır. Polimer üretimi için her yıl tonlarca MMA monomeri üretilir. Erime noktası -48 °C, kaynama noktası 101 °C'dir.

Kloroplatinik asit (hekzakloroplatinik asit olarak da bilinir), [H3O]2[PtCl6](H2O)x (0≤x≤6) formülüne sahip bir inorganik bileşiktir. Kırmızı bir katı, genellikle sulu bir çözelti olarak önemli bir platin kaynağıdır. Genellikle kısaca H2PtCl6 olarak yazılsa da, hekzakloroplatinat anyonunun (PtCl62-) hidronyum (H3O+) tuzudur. Hekzakloroplatinik asit oldukça higroskopiktir.

Metanamid olarak da bilinen formamid, formik asitin amididir. Su ile karışabilen ve amonyak benzeri bir kokuya sahip berrak bir sıvıdır. Sülfa ilaçları, diğer farmasötikler, herbisitler, böcek ilaçları ve hidrosiyanik asit üretimi için kimyasal hammaddedir. Kâğıt ve elyaf için yumuşatıcı olarak kullanılmıştır. Birçok iyonik bileşik için bir çözücüdür. Reçineler ve plastikleştiriciler için bir çözücü olarak da kullanılmıştır.
Amonyum hidroksit, oda sıcaklığında gaz hâlde bulunan amonyağın sulu çözeltisine verilen addır. Formülü olarak NH4+.OH- gösterilir.

Sodyum tiyosiyanat (bazen sodyum sülfosiyanür olarak da adlandırılır) NaSCN formülüne sahip kimyasal bileşiktir. Bu renksiz sulangan tuz tiyosiyanat anyonunun ana kaynaklarından biridir. Bu haliyle, ilaçların ve diğer özel kimyasal maddelerin sentezinde bir öncül madde olarak kullanılmaktadır. Tiyosiyanat tuzları tipik olarak siyanürün elementel kükürt ile olan reaksiyonuyla hazırlanır:
- 8 NaCN + S8 → 8 NaSCN

Organik kimyada, amoksidasyon amonyak ve oksijen kullanılarak nitrillerin üretilmesi işlemidir. Amoksidasyonun Standard Oil of Ohio'da geliştirildiği kabul edildiğinden bazen SOHIO işlemi olarak adlandırılır. Alışıldık substratlar alkendir. Yılda birkaç milyon ton akrilonitril bu şekilde üretilir:


Diamonyum fosfat (DAP; IUPAC adı diamonyum hidrojen fosfat; kimyasal formülü (NH4)2(HPO4) olan amonyak]] ve fosforik asitin reaksiyonu ile üretilebilen bir dizi suda çözünür amonyum fosfat tuzlarından biridir.
Organik kimyada nitril, −C≡N fonksiyonel grubuna sahip herhangi bir organik bileşiktir. Siyano- ön eki, endüstriyel literatürde nitril terimi ile eş anlamlıdır. Nitriller, süper yapıştırıcılarda kullanılan metil siyanoakrilat ve lateks içermeyen laboratuvar ve tıbbi eldivenlerde kullanılan nitril içeren bir polimer olan nitril kauçuk dahil olmak üzere birçok yararlı bileşikte bulunur. Asetonitril çözücü olarak kullanılır.

Amonyum hidrojen sülfat olarak da bilinen amonyum bisülfat, (NH4) HSO4 formülüne sahip beyaz, kristalimsi bir katıdır. Bu tuz, sülfürik asidin amonyakla yarı nötralizasyonunun ürünüdür.