Aminoasil-tRNA

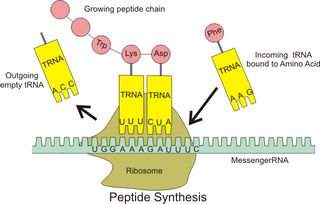
Aminoasil-tRNA (aynı zamanda aa-tRNA veya yüklü tRNA), aynı kökenli amino asidinin kimyasal olarak bağlı (yüklü) olduğu tRNA'dır. aa-tRNA, belirli uzama faktörleriyle birlikte, translasyon sırasında üretilen polipeptit zincirine dahil edilmek üzere amino asidi ribozoma iletir.
Tek başına, bir amino asit, büyüyen bir polipeptit zinciri içinde peptit bağlarının oluşumuna izin vermek için gerekli substrat değildir. Bunun yerine, ilgili aa-tRNA'larını oluşturmak için amino asitlerin bir tRNA ile "yüklenmesi" veya aminoasile edilmesi gerekir.[1] Her amino asidin kendine özgü aminoasil-tRNA sentetazı vardır ve bu sentetaz, spesifik olduğu tRNA'ya kimyasal olarak bağlanmak veya başka bir deyişle "eş kökenli" olmak için kullanılır. Protein sentezi sırasında yalnızca tRNA'nın antikodonuyla eşleşen ve sırayla mRNA'nın kodonuyla eşleşen belirli amino asidin kullanılmasını sağladığından, bir tRNA'nın aynı kökenli amino asidiyle eşleşmesi çok önemlidir.
Polipeptit zincirine yanlış amino asidin dahil edildiği translasyon hatalarını önlemek için evrim, aa-tRNA sentetazlarının prova okuma işlevselliklerini sağlamıştır; bu mekanizmalar, bir amino asidin kendi aynı kökenli tRNA'sına uygun şekilde eşleşmesini sağlar.[2] Uygun tRNA substratı ile misasillenmiş amino asitler, aa-tRNA sentetazlarının sahip olduğu deasilasyon mekanizmaları yoluyla hidrolize uğrar.[3]
Genetik kodun dejenerasyonundan dolayı, çoklu tRNA'lar aynı amino aside ancak farklı antikodonlara sahiptirler. Bu farklı tRNA'lara izoalıcı denir. Belirli koşullar altında, aynı kökenli olmayan amino asitler yüklenecek ve bu da yanlış yüklenmiş veya yanlış aminoasile edilmiş tRNA ile sonuçlanacaktır. Bu hatalı yüklenmiş tRNA'lar, hatalı protein sentezini önlemek için hidrolize edilmelidir.
aa-tRNA, protein sentezi sırasında mRNA kodlama zinciri ile kodlanmış polipeptit zinciri arasında birincil olarak ara bağlantı olarak hizmet ederken, aa-tRNA'nın başka birçok biyosentetik yolda işlevleri olduğu da bulunmuştur. aa-tRNA'ların hücre duvarları, antibiyotikler, lipitler ve protein yıkımı için biyosentetik yollarda substratlar olarak işlev gördüğü bulunmuştur.
aa-tRNA'ların, lipidlerin modifikasyonu ve antibiyotiklerin biyosentezi için gerekli amino asitlerin donörleri olarak işlev görebileceği görülmüştür. Örneğin, mikrobiyal biyosentetik gen kümeleri, ribozomal olmayan peptitlerin ve diğer amino asit içeren metabolitlerin sentezinde aa-tRNA'ları kullanabilir.[4]
Sentezi
Aminoasil-tRNA iki adımda üretilir. İlk adım, aminoasil-AMP oluşturan amino asidin adenilasyonudur:
İkinci adım, amino asit kalıntısının tRNA'ya aktarılmasıdır:
Genel net reaksiyon şu şekildedir:
Net reaksiyon, yalnızca pirofosfatın (PPi) daha sonra hidrolize olması nedeniyle enerji açısından uygundur. Pirofosfatın iki molekül inorganik fosfat (Pi) reaksiyonuna hidrolizi, enerji açısından oldukça elverişlidir ve diğer iki reaksiyonu yönlendirir. Birlikte, bu yüksek düzeyde ekzergonik reaksiyonlar, o amino aside özgü aminoasil-tRNA sentetaz içinde gerçekleşir.[5][6]
Stabilite ve hidroliz
aa-tRNA'ların stabilitesi üzerine yapılan araştırmalar, asil (veya ester) bağlantısının, tRNA'nın kendisinin dizisinin aksine, en önemli faktör olduğunu göstermektedir. Bu bağlantı, bir amino asidin karboksil grubunu, aynı kökenli tRNA'sının terminal 3'-OH grubuna kimyasal olarak bağlayan bir ester bağıdır.[7] Belirli bir aa-tRNA'nın amino asit parçasının yapısal bütünlüğünü sağladığı keşfedilmiştir; tRNA kısmı, çoğunlukla, amino asidin büyüyen bir polipeptit zincirine nasıl ve ne zaman dahil edileceğini belirler.[8]
Farklı aa-tRNA'lar, amino asit ve tRNA arasındaki ester bağının hidrolizi için değişen birinci derece hız sabitlerine sahiptir.[9] Bu tür gözlemler öncelikle sterik etkilerden kaynaklanmaktadır. Sterik engel, ester karbonil üzerindeki moleküller arası saldırıların önlenmesine yardımcı olan amino asitlerin spesifik yan zincir grupları tarafından sağlanır; bu moleküller arası saldırılar, ester bağının hidrolize edilmesinden sorumludur.
Dallanmış ve alifatik amino asitler (valin ve izolösin), sentezleri üzerine, düşük hidrolitik stabiliteye sahip olanlardan (örneğin, prolin) belirgin şekilde daha uzun yarı ömürlerle, en kararlı aminoasil-tRNA'ları ürettiğini kanıtlar. Valin ve izolösin amino asitlerinin sterik engellemesi, yan zincirin β-karbonundaki metil grubu tarafından üretilir. Genel olarak, bağlı amino asidin kimyasal yapısı, aa-tRNA'nın stabilitesinin belirlenmesinden sorumludur.[10]
Sodyum, potasyum ve magnezyum tuzlarından kaynaklanan artan iyonik gücün aa-tRNA asil bağını kararsızlaştırdığı görülmüştür. Artan pH ayrıca bağı destabilize eder ve amino asidin a-karbon amino grubunun iyonizasyonunu değiştirir. Yüklü amino grubu, indüktif etki yoluyla aa-tRNA bağını kararsızlaştırabilir.[11] Uzama faktörü EF-Tu'nun, zayıf asil bağlantılarının hidrolize olmasını önleyerek bağı stabilize ettiği görülmüştür.[1]
Hepsi birlikte, ester bağının gerçek kararlılığı, aa-tRNA'nın vücut içinde fizyolojik pH ve iyon konsantrasyonlarında hidrolize duyarlılığını etkiler. Aminoasilasyon işleminin kararlı bir aa-tRNA molekülü vermesi, polipeptit sentezinin hızlanmasını ve üretkenliğini sağlaması termodinamik olarak uygundur.[1]
İlaçlarla ilgisi
Tetrasiklin gibi belirli antibiyotikler, aminoasil-tRNA'nın prokaryotlarda ribozomal alt birime bağlanmasını engeller. Tetrasiklinlerin, translasyon sırasında prokaryotik ribozomların alıcı (A) bölgesi içinde aa-tRNA'nın bağlanmasını engellediği görülür. Tetrasiklinler geniş spektrumlu antibiyotik ajanlar olarak kabul edilir; bu ilaçlar, hem gram-pozitif hem de gram-negatif bakterilerin yanı sıra diğer atipik mikroorganizmaların büyümesini inhibe etme yetenekleri sergiler.
Ayrıca, TetM proteininin (P21598), bu tür eylemleri tipik olarak inhibe edecek olan tetrasiklinlerle konsantre olmasına rağmen, aminoasil-tRNA moleküllerinin ribozomal akseptör bölgesine bağlanmasına izin verdiği bulunmuştur. TetM proteini, ribozomlara bağlı GTPaz aktivitesi sergileyen bir ribozomal koruma proteini olarak kabul edilir. Araştırmalar, TetM proteinlerinin varlığında ribozomlardan tetrasiklinlerin salındığını göstermiştir. Böylece, bu artık tetrasiklin molekülleri tarafından engellenmediği için ribozomların A bölgesine aa-tRNA bağlanmasına izin verir.[12] TetO, TetM'ye %75 oranında benzemektedir ve her ikisinin de EF-G ile %45 benzerliği vardır. E. coli ribozomu ile kompleks halindeki TetM'nin yapısı çözülmüştür.[13]
Ayrıca bakınız
- Aminoasil-tRNA sentetaz
Kaynakça
- ^ a b c Peacock JR, Walvoord RR, Chang AY, Kozlowski MC, Gamper H, Hou YM (June 2014). "Amino acid-dependent stability of the acyl linkage in aminoacyl-tRNA". RNA. 20 (6): 758-64. doi:10.1261/rna.044123.113. PMC 4024630 $2. PMID 24751649.
- ^ Kelly P, Ibba M (January 2018). "Aminoacyl-tRNA Quality Control Provides a Speedy Solution to Discriminate Right from Wrong". Journal of Molecular Biology. 430 (1): 17-19. doi:10.1016/j.jmb.2017.10.025. PMID 29111345.
- ^ Francklyn CS, Mullen P (April 2019). "Progress and challenges in aminoacyl-tRNA synthetase-based therapeutics". The Journal of Biological Chemistry. 294 (14): 5365-5385. doi:10.1074/jbc.REV118.002956. PMC 6462538 $2. PMID 30670594.
- ^ Ulrich EC, van der Donk WA (December 2016). "Cameo appearances of aminoacyl-tRNA in natural product biosynthesis". Current Opinion in Chemical Biology. 35: 29-36. doi:10.1016/j.cbpa.2016.08.018. PMC 5161580 $2. PMID 27599269.
- ^ Swanson R, Hoben P, Sumner-Smith M, Uemura H, Watson L, Söll D (December 1988). "Accuracy of in vivo aminoacylation requires proper balance of tRNA and aminoacyl-tRNA synthetase". Science. 242 (4885): 1548-51. Bibcode:1988Sci...242.1548S. doi:10.1126/science.3144042. PMID 3144042. 15 Temmuz 2021 tarihinde kaynağından arşivlendi. Erişim tarihi: 8 Mayıs 2022.
- ^ McClain WH (November 1993). "Rules that govern tRNA identity in protein synthesis". Journal of Molecular Biology. 234 (2): 257-80. doi:10.1006/jmbi.1993.1582. PMID 8230212.
- ^ Kelly P, Ibba M (January 2018). "Aminoacyl-tRNA Quality Control Provides a Speedy Solution to Discriminate Right from Wrong". Journal of Molecular Biology. 430 (1): 17-19. doi:10.1016/j.jmb.2017.10.025. PMID 29111345.
- ^ Francklyn CS, Mullen P (April 2019). "Progress and challenges in aminoacyl-tRNA synthetase-based therapeutics". The Journal of Biological Chemistry. 294 (14): 5365-5385. doi:10.1074/jbc.REV118.002956. PMC 6462538 $2. PMID 30670594.
- ^ Hentzen D, Mandel P, Garel JP (October 1972). "Relation between aminoacyl-tRNA stability and the fixed amino acid". Biochimica et Biophysica Acta (BBA) - Nucleic Acids and Protein Synthesis. 281 (2): 228-32. doi:10.1016/0005-2787(72)90174-8. PMID 4629424.
- ^ Kelly P, Ibba M (January 2018). "Aminoacyl-tRNA Quality Control Provides a Speedy Solution to Discriminate Right from Wrong". Journal of Molecular Biology. 430 (1): 17-19. doi:10.1016/j.jmb.2017.10.025. PMID 29111345.
- ^ Schuber F, Pinck M (May 1974). "On the chemical reactivity of aminoacyl-tRNA ester bond. I. Influence of pH and nature of the acyl group on the rate of hydrolysis". Biochimie. 56 (3): 383-90. doi:10.1016/S0300-9084(74)80146-X. PMID 4853442.
- ^ Chopra I, Roberts M (June 2001). "Tetracycline antibiotics: mode of action, applications, molecular biology, and epidemiology of bacterial resistance". Microbiology and Molecular Biology Reviews. 65 (2): 232-60 ; second page, table of contents. doi:10.1128/MMBR.65.2.232-260.2001. PMC 99026 $2. PMID 11381101.
- ^ Arenz, S; Nguyen, F; Beckmann, R; Wilson, DN (28 Nisan 2015). "Cryo-EM structure of the tetracycline resistance protein TetM in complex with a translating ribosome at 3.9-Å resolution". Proceedings of the National Academy of Sciences of the United States of America. 112 (17): 5401-6. Bibcode:2015PNAS..112.5401A. doi:10.1073/pnas.1501775112. PMC 4418892 $2. PMID 25870267.