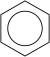
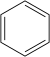
Alkanlar, (diğer bir deyişle Parafinler) sadece karbon (C) ve hidrojen (H) elementlerinin bulunduğu ve bu elementlerin birbirleriyle tekli bağ yaptığı doymuş alifatik organik bileşiklerin genel ismidir. Alkanlar birbirlerini 1 karbon ve 2 hidrojen ile takip eden bir homolog seri oluştururlar. Örneğin tek karbonlu metan, CH4 formülüne sahipken, çift karbonlu etan C2H6 kapalı formülüne sahiptir. Alkanlarda tüm atomlar tekli bağlarla birbirlerine bağlandığı ve Karbon atomunu bağlayabileceği en fazla Hidrojen atomunu bağladığından dolayı doymuş bileşikler kategorisine girerler. Doymuş hidrokarbonlardan olan alkanlar, CnH2n+2 n=1,2,3,.... genel formülüne sahiptir. Burada n'in 3 veya 3'ten büyük olması hâlinde sikloalkan denilen halkalı yapılar oluşabilmektedirler.

Alkenler yapılarında en az bir tane karbon-karbon (C=C) çift bağı içeren organik bileşiklerdir. Alkenlerin yapısında karbon-karbon çift bağı bulunduğundan ve bu karbonların yapabileceği en fazla hidrojenle bağ yapmamış olduğundan alkenler doymamış bileşikler kategorisine girerler. Alkenlerin yapısında sadece bir karbon-karbon çift bağının bulunması durumunda homolog seriler oluşturur. Bu homolog serilerin genel formülü CnH2n şeklindedir. Burada n-in en az 2 olma şartı vardır. Aşağıda en basit alken olan eten, yaygın ismiyle etilenin, çeşitli modellemelerle çizilmiş şekillerinin yanı sıra alkenlerin çeşitli şekillerdeki yazılış şekilleri de bulunmaktadır.

Maltoz (malt şekeri veya di-glikoz olarak da bilinir), C12H22O11 moleküler formüllü bir disakkarittir. Sistematik ismi α-D-Glukopiranozil-(1→4)-α-D-Glukopiranoz'dur. Maltoz suda iyi çözülür ve tatlı bir tadı vardır. Eğer Maltozu Sakkarozla karşılaştıracak olursak %10 D-Maltozun tatlılık derecesi %41'lik Sakkarozunkine denk gelmektedir. Suda çözülmüş Maltozun kristalleştirilmesiyle monohidratlar oluşmaktadır. Aynı zamanda maltoz çimlenmiş arpada ve patatesin tohumlarında da görülmektedir.
Hidrojenasyon, bir kimyasal reaksiyon sınıfıdır ve organik bileşiklere hidrojen (H2) eklenmesi işlemidir. Hidrojenasyon, özellikle doymamış organik bileşikler (alkenler, alkinler, ketonlar ve nitriller ) için önemli bir reaksiyondur. Genellikle basınç altında katalizörler yardımı ile direkt hidrojen eklemesi ile gerçekleştirilir. Hidrojenasyon için en klasik örnek, alkenlerdeki doymamış karbon kimyasal bağına bir hidrojenin ekleyerek, alkeni alkana dönüştürmektir. İlaç ve petrokimya endüstrisinde çok değişik uygulamaları vardır. Bu kimyasal işlemin tersi dehidrojenasyondur. Alkenlere hidrojenin katılması sonucunda Alkanlar oluşur. Alkankar sadece karbon-karbon tekli bağlara sahiptirler. Bu tepkimede katalizör kullanıldığından katalitik hidrojenleme olarak da adlandırılır. Alkenlere hidrojen katılma tepkimeleri ekzotermik tepkimeler olup oda sıcaklığında katalizörsüz tepkime gerçekleşmez. Burada katalizör kullanılarak tepkimenin oda sıcaklığında gerçekleşmesi sağlanır. Yalnız katalizörün etkisi bununla sınırlı kalmıyor. Kullanılan katalizör elde edilecek olan ürünün cis-Alkan ya da trans-Alkan olmasını etkilemektedir. Eğer kullanılan katalizör heterojen bir katalizör ise, (bir parça nikel, platin, paladyum) yani çözelti içerisinde heterojen olarak karışıyorsa katılan her iki hidrojen atomu alkenin aynı tarafına eklenir ve böylece cis-Alkan oluşur. Şayet bu katalizör çözelti içerisinde homojen olarak yayılan bir katalkizörse bu seferde trans-Alkan oluşmuş olacak.

Alanin (Ala, A) (HO2CCH(NH2)CH3) aynı zamanda 2-aminopropanoik asit olarak adlandırılır. En sık kullanılan aminoasittir. Proteinlerin yaklaşık olarak %7.8'i alanin yapıtaşlarından oluşmaktadır. D-alanin, bazı bakterilerin hücre duvarlarında ve peptid antibiyotiklerin yapılarında da bulunmaktadır.
Esterleşme, esterler genel olarak karbon asitlerinden elde edilmektedirler. Burada karbon asitlerinde bulunan –OH grubu (alkol) bir –OR grubuyla yer değiştirmesi sonucunda oluşmaktadır. Esterleşme tepkimelerin gerçekleşmesi için ısının yanı sıra katalizör olarak da genellikle Sülfürik asit ve hidroklorik asit kullanılmaktadır. Aşağıdaki tabloda asit katalizörle tepkimesini gösteren bir şema görebiliriz.
Asparajin proteinleri oluşturan 20 aminoasitten biridir. Yan zincirinde karboksamit grubu içerir. Polar özelliktedir, ancak fizyolojik pH'da yüksüzdür. L-Asparajin, merkezi sinir sisteminin dengesinin korunması için gereklidir. Aşırı sinir ve asabiyet oluşumunu engeller, teskin edici özelliği vardır.

Friedrich Wöhler, Alman kimyager. Üreyi laboratuvarda sentezleyen ilk bilim insanıdır.

Vulkanizasyon, 1839’da Charles Goodyear tarafından keşfedilen bir kimyasal-teknik yöntemidir. Bu yöntem kauçuğun ya da benzer polimerlerin, kükürt veya diğer eşdeğer kükürtleyicilerin ilavesiyle daha dayanıklı malzemelere dönüştürülmesi işlemidir.
Katılma tepkimeleri, bir organik molekülün yapısına dışarıdan başka bir molekülün katılmasıdır. Organik kimyada yapısında karbon-karbon çift bağı (Alken) ya da karbon-karbon üçlü bağı (Alkin) bulunduran molekülerlerin yapısına dışarıdan en az iki elementin girmesiyle gerçekleşen tepkimelerdir. İşte bu tepkimeler sonucu yapısında çoklu bağ bulunduran moleküldeki çoklu bağlar kırılarak yerlerine tekli bağlar oluşur.
Halojenleme veya halojenasyon, bir bileşiğe bir veya daha fazla halojenin katılmasını gerektiren kimyasal bir reaksiyondur. Alkenler, klor ve brom gibi halojenlerle, nükleofillik özelliği göstermeyen çözücüler içerisinde hızla tepkimeye girerler ve dihalojenleri oluştururlar. Bromun katılması daha kolay takip edilebilmektedir. Çünkü kırmızı-kahve rengi olan Brom çözeltisinin rengi ortadan kalkar. Bu yöntem özellikle çift bağların varlığını kanıtlamada kullanılır. Burada alken doymamış bir molekül olduğu için bromla tepkimeye girerken, alkanlar ise ortamda radikal bir çözelti olmadığı sürece tepkime vermez. Genel itibarıyla bu tepkimeler ya oda sıcaklığında ya da soğuk bir ortamda inert halojen çözücülerinin (CCl4) varlığında uygulanır.
Alkenler sülfürik asitin katılması soğuk bir ortamda bile tepkime verip Alkil hidrojen sülfat bileşiklerini vermektedir. Genel itibarıyla bu tepkime alkenlere hidrojen halojen katılma tepkimeleriyle benzerlik göstermektedir.

Alkinler, hidrokarbon zincirinde en az bir tane karbon-karbon üçlü bağı içeren organik bileşiklerdir. Yapısında sadece bir tane karbon-karbon üçlü bağı bulunduran alkinler, homolog bir sıra oluştururlar ve CnH2n-2 n=2,3,4... genel formülüne sahiptirler. En basit alkin asetilendir (C2H2, etin). Alkinlerin yapısında en az karbon–karbon üçlü bağı bulunduğundan ve moleküldeki karbonlar bağlıya bileceği en fazla hidrojen atomunu bağlamadıklarından doymamış moleküller kategorisine girerler. İlk kez en basit alkin, asetilen ünlü İngiliz kimyager Humphry Davy’in kuzeni olan Edmund Davy tarafından bulunmuştur.
Nükleofil ismi, atomun artı kısmı manasına gelen nucleo ve Yunancada seven manasına gelen philos kelimelerinden oluşmaktadır. İsimden de anlaşılacağı gibi nükleofiller artı parçacıkları seven artı merkez arayışı içinde olan moleküllerdir. Bu tür tepkimelerde nükleofiller yani bir çift ortaklaşmamış elektrona sahip molekül, bir alkil halojenürün halojen kısmıyla yer değiştrir işte bu şekilde gerçekleşen yer değişikliklerine Nükleofil yer değiştirme tepkimeleri denir. Elektronegatif halojen elektronları kendine doğru çektiğinden dolayı Karbon otomu üzerinde kısmi bir pozitif yük oluşmuş oluyor. Bu tepkimede de görüldüğü gibi bir yer değiştirme işlemi vardır.
Primer tarihte ilk olarak kimyada "ilk çıkan, temelini oluşturan" manasında kullanılmıştır. Örneğin primer ürünler ve primer tepkimeler gibi.
Sekunder, Latincedeki 'Secundarius' kelimesinden gelmektedir. Kimyada ise ikinci sıradaki anlamında kullanılmaktadır.
Alkenler sülfürik asitin katılması soğuk bir ortamda bile tepkime verip Alkil hidrojen sülfat bileşiklerini vermektedir. Genel itibarıyla bu tepkime alkenlere hidrojen halojen katılma tepkimeleriyle benzerlik göstermektedir.

Peroksitler, R−O−O−R yapısına sahip bir grup bileşiktir. Bir peroksit içindeki O−O fonksiyonel grubu, peroksit grubu veya perokso grubu olarak adlandırılır. Oksit iyonlarının aksine, peroksit iyonundaki oksijen atomları -1 yükseltgenme seviyesine sahiptir.

1,3-Dinitrobenzen C6H4(NO2)2 formülüne sahip bir organik bileşiktir. Dinitrobenzenin üç izomerinden biridir. Bileşik, organik çözücüler içinde çözülebilen sarı bir katıdır.

Tetrasakkaritler, hidroliz ile farklı monosakkaritlerden dört molekül alınıp dehidrasyon tepkimeleri ile birleştirilmesi ile oluşan bir karbonhidrat çeşididir. Tetrasakkaritler, üç eşdeğer su ile dört monosakkarit biriminden (basit şekerler) oluşur. Tetrasakkaritte, monosakkarit birimleri, üç glikosidik bağ yoluyla birbirine kovalent olarak bağlanır. Oligosakkaritler grubuna aittirler. Bir tetrasakkaritin genel formülü C24H42O21 şeklindedir.