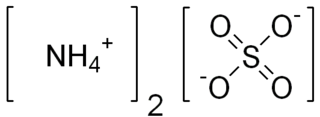Alçı taşı


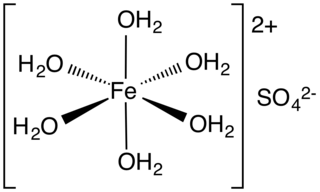
Alçı taşı, kalsiyum sülfat dihidrattan oluşan yumuşak bir sülfat mineralidir ve kimyasal formül CaSO4 · 2H2O'dur.[1] Alçıtaşı ayrıca selenitin yarı saydam kristalleri olarak kristalleşir. Aynı zamanda bir evaporit minerali ve anhidritin hidrasyon ürünü olarak oluşur.[2] İçinde su bulunan kalsiyum sülfat minerali, tek veya ikiz sütunlar hâlinde billûrlanır. Alçı billurlarına kil ve marn içinde veya tuzlu ve alçılı dağların boşluklarında rastlanır.
Eski Mısır, Mezopotamya, Antik Roma, Bizans İmparatorluğu ve Orta Çağ İngiltere'sinin Nottingham alabasters dahil olmak üzere birçok kültür tarafından heykel için büyük ince taneli beyaz veya hafif renkli alçı kullanılmıştır.[2]
Anadolu'da kaya tuzu ile birlikte bilhassa yukarı Kızılırmak bölgesinde büyük kayalar hâlinde bulunur.
Alçı taşı iki şekilde işlenerek birbirinden farklı iki cins alçı elde edilir.
Birinci şekilde alçı taşı kırılır, değirmenlerde ufalanır, tuğla fırınlarında 120 dereceye kadar ısıtılarak içindeki suyun bir miktarı alınır ve tekrar değirmenden geçirilerek toz haline getirilir. Bilhassa kalıp, model, tavan süsleri yapılmasında kullanılan bu cins alçı, su ile karıştırılırsa en geç yarım saat içinde donar.
İkinci şekil alçı elde etmek, alçı taşının değirmende ufalanmasından sonra 450 dereceye kadar ısıtılarak içindeki suyun tamamen alınması ile olur. Bu cins alçılar, su ile karıştırıldığında birkaç hafta sonra donar ve çok dayanıklı bir kütle haline gelir.Mohs mineral sertlik ölçeği, çizilme sertliği karşılaştırmasına dayanarak sertlik değeri 2'yi alçı olarak tanımlar.[2]
Tarihçesi
Alçı sözcüğü, Yunanca γύψος (gypsos), "alçı" kelimesinden türetilmiştir.Paris'in Montmartre bölgesindeki taş ocakları, çeşitli amaçlar için uzun süredir yanmış alçıtaşı (kalsine alçı) kullandığı için, bu susuz alçı Paris'in sıvası olarak bilinir hale geldi.
Alçı, Eski İngilizcede kristal projeksiyonlarına atıfta bulunan spærstān, "mızrak taşı" olarak biliniyordu.
18. yüzyılın ortalarında Alman din adamları ve ziraatçi Johann Friderich Mayer, alçının gübre olarak kullanımını araştırdı ve duyurdu.
19. yüzyılda, kireç sülfat veya kireç sülfat olarak da biliniyordu.
Fiziki özellikleri
Alçı orta derecede suda çözünür (25 °C'de ~ 2.0-2.5 g / l) [7] ve diğer birçok tuzun aksine, retrograd çözünürlük sergiler, daha yüksek sıcaklıklarda daha az çözünür hale gelir. Alçı havada ısıtıldığında su kaybeder ve önce kalsiyum sülfat hemihidrata dönüşür, (bassanit, genellikle basitçe "alçı" olarak adlandırılır) ve daha fazla ısıtıldığında susuz kalsiyum sülfata (anhidrit). Anhidrite gelince, tuzlu su çözeltileri ve tuzlu sulardaki çözünürlüğü de güçlü bir şekilde NaCl (yaygın sofra tuzu) konsantrasyonuna bağlıdır.
Alçı kristallerinin anyon suyu ve hidrojen bağı içerdiği bulunmuştur.
Alçı türleri
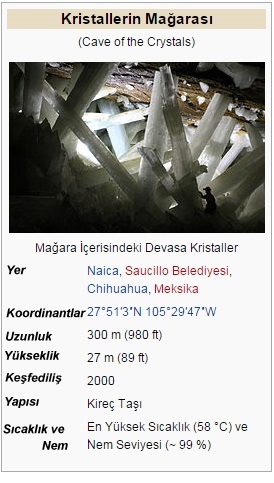
Alçı, doğada düzleştirilmiş ve çoğunlukla ikiz kristaller ve selenit adı verilen şeffaf, parçalanabilir kütleler olarak ortaya çıkar. Selenit ayrıca ipeksi, lifli bir formda ortaya çıkabilir, bu durumda yaygın olarak "saten spar" olarak adlandırılır. Son olarak, granül veya oldukça kompakt da olabilir.
Alabaster olarak adlandırılan çok ince taneli beyaz veya açık renkli bir alçı çeşidi, çeşitli türlerin süs işleri için ödüllendirilir.
Kurak bölgelerde, alçıtaşı, genellikle opak, çöl gülü adı verilen gömülü kum taneleri ile çiçek benzeri bir formda ortaya çıkabilir.
Bulunuşu
Deniz suyundaki büyük çözünülürlüğü halit ve anhidrit minerallerine göre daha zayıf olan ve evaporasyonda ilk çökelen mineraldir. Karbonatlı kayalarda piritin oksidasyonundan türeyen sülfirik asitin bulunduğu yerlerde ve bazı volkanik alanlarda da oluşabilir.
Tarımda kullanımı
Kireçli topraklarda dahi kalsiyum elementinin bitkilerce kalsiyumun karbonat olarak bağlı tutulamsı sebebiyle alınmasında zorluklar olduğu bilinmektedir. Ayrıca topraklarımızda çok uzun zamandır gübre kullanımıyla biriken veya verilmekte olan çinko, demir, fosfor ve potasyum gibi elementler yüksek pH değerlerinde bitkilerce alımları zor olmaktadır. Bu nedenle kalsiyum sülfat bileşimine sahip olan jips, hem topraklarda pH dengesini sağlamakta, hem de bitkilerin iskelet yapılarında çok önemli olan kalsiyumu sağlamaktadır.
Özellikleri
- Kimyasal bileşimi, CaSO4.2 H2O
- Kristal sistemi, monoklinik
- Kristal şekli çoğunlukla ince-kalın levhamsı kristalli; kısa-uzun prizmatik, iğnemsi, masif, tanesel, lifsi
- İkizlenme, {100} yüzeyinde kırlangıç kuyruğu, {-101} yüzeyinde kelebek ikizleri çok tipiktir.
- Sertliği 2'dir
- Özgül ağırlık, 2,32
- Dilinim, {010} mükemmel
- Renk ve şeffaflık, renksiz-beyaz, sarımsı, yeşilimsi, kırmızımsı; şeffaf-yarı şeffaf
- Çizgi rengi beyaz
- Parlaklığı camsı
- Ayırıcı özellikleri, düşük sertliği ve dilinimidir
Kullanım alanları
- Ham jips, beyaz boya ve dolgu maddesi olarak kâğıt ve pamuklu tekstil maddelerine katılır.
- Ham jips çimento sanayiinde prizlenmeyi geciktirir.
- Nikel izabesinde eritmeyi kolaylaştırır.
- Bira sanayiinde mayalandırma için kullanılır.
- Alçı, tıpta cerrahide ve dişçilikte kullanılır.
- Alçı vitrifiye malzemelerde, porselende ve kiremit üretiminde kalıp aşamasında kullanılır.
- Kimya sanayiinde amonyum sülfat, kükürt, kükürt okside ve sülfat asidi elde etmek için kullanılır.
- Mamul alçı inşaat ve prefabrik inşaat malzemelerinin başlıca girdisidir. Alçının inşaatta kullanım yeri çok çeşitlidir. Son yıllarda sıcak ve soğuk yalıtım maddesi, ses izolatörü ve rutubeti de ayarlayan bir düzenleyici olarak kullanılmaktadır.[3]
Kaynakça
- ^ "Alçıtaşı". 9 Aralık 2003 tarihinde kaynağından arşivlendi.
- ^ a b c "alçıtaşı". 9 Aralık 2003 tarihinde kaynağından arşivlendi.
- ^ "Jips". 18 Mart 2009 tarihinde kaynağından arşivlendi. Erişim tarihi: 8 Mayıs 2009.