Termit reaksiyonu Alüminyum'un başka bir metal oksidi ile girdiği reaksiyondur. Bu maddelerin karışımına da Termit adı verilir. Ortalama 2370 °C 'de gerçekleşen reaksiyon sonucunda Alüminyum oksit, diğer metalin element hali ve çok büyük miktarda ısı açığa çıkar.

Arsin AsH3 formüllü inorganik bileşik. Bu yanıcı ve fazlaca zehirli gaz, arsenik elementinin en basit bileşiklerinden biridir.

Kobalt kimyasal bir element'tir. Sembol'ü Co ve atom numarası 27'dir. Nikel gibi kobalt da, doğal meteorik demir alaşımlarında bulunan küçük birikintiler dışında, yer kabuğunda yalnızca kimyasal olarak birleşik formda bulunur. İndirgeyici eritme yoluyla üretilen serbest element sert, parlak, gümüş rengi bir metal'dir.

Aktinyum, simgesi Ac ve atom numarası 89 olan kimyasal bir elementtir. İlk olarak 1899'da Fransız kimyager André-Louis Debierne tarafından izole edilmiştir.

Hidroklorik asit, hidrojen ve klor elementlerinden oluşan, oda sıcaklığı ve normal basınçta gaz hâlinde olan hidrojen klorürün sulu çözeltisine verilen ad. Halk arasında tuz ruhu olarak da bilinir. 9. yüzyılda simyacı Câbir bin Hayyân tarafından keşfedildi ve sonrasında simya alanında kullanıldı. Sanayi Devrimi sırasında, sanayideki önemi keşfedilen asit, önce Leblanc işlemi, sonrasında Solvay işlemi ile sanayi alanında üretilmeye başladı. Hidroklorik asit, tarihte yeni kolaylıkların keşfinde önemli roller üstlendi. Günümüzde PVC'den demir-çeliğe, organik madde üretiminden gıda sektörüne kadar hemen hemen tüm alanlarda hidroklorik asit kullanılmaktadır.

Azot monoksit, kimyasal formülü NO olan bir bileşiktir. Bu gaz, -insanlar da dahil olmak üzere- memelilerin vücutlarında önemli bir sinyal molekülü olmasının yanı sıra kimyasal endüstride de önemli bir ara üründür. Ayrıca NO, araba motorları ve elektrik santralleri tarafından üretilerek hava kirliliğine neden olur.
Termit bombası, alüminyumun farklı metal oksitlerle reaksiyona girdiği bomba türüdür.
Bilinen inorganik ve organometalik bileşiklerin elementlere göre sıralanmış listesidir. Sıralama elementlerin kısaltmalarının alfabetik sırasına göredir.

Bakır(I) oksit ya da küproz oksit formülü Cu2O olan inorganik bileşiktir. Bakırın oksitlerinden biridir. Bu kırmızı renkli katı bazı yosun önleyici boyaların bileşimine girmektedir. Bu bileşik, tanecik büyüklüğüne bağlı olarak sarı ya da kırmızı renkli olabilir. Bakır(I) oksit kırmızımsı renkteki kuprit minerali halinde bulunur.
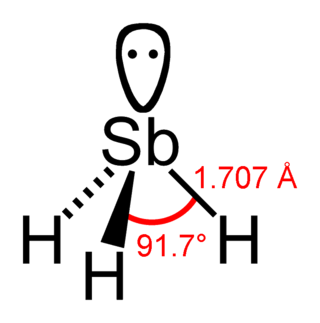
Stibin SbH3 formüllü bileşik. Son derece zehirli bir gaz olup çip üretiminde silisyuma antimon karıştırmak için kullanılır.

Alüminyum klorür (AlCl3), alüminyum ve klorürün temel bileşiği. Rengi genel olarak beyazdır fakat Demir(III) klorür ile etkileşime girdiğinde sarı bir renk alır. Katı erime ve kaynama noktası düşüktür. Genel olarak alüminyum metallerin üretiminde kullanılır. Ayrıca kimya endüstrisinin diğer alanlarında da yüksek miktarda kullanılır. Bileşik sıklıkla Lewis asiti olarak anılır.
Alüminyum bromür veya diğer adıyla alüminyum tribromür, içinde alüminyum ve brom bulunan, kimyasal formülü AlBr3 veya Al2Br6 olan kimyasal birleşik Mol kütlesi 374,8 gram, erime noktası 97 °C, kaynama noktası 255 °C, yoğunluğu 3,01 g/mL olan suda çözünebilen bir maddedir. Sentezlerde açilleme katalizörü olarak kullanılan, beyazdan sarıya değişen renkte, nem çekici, kristal yapıda bir maddedir. Havada kuvvetle dumanlanır, suyla şiddetle birleşir. Organik çözücülerde çözünür. Dimer biçiminde de bulunur (Al2Br6).
İyot pentafluorür, IF5 kimyasal formülüne sahip florür ve iyottan oluşan bir interhalojen bileşiktir. 3.250 g cm−3 yoğunluğa sahip, renksiz veya sarı bir sıvıdır. İlk olarak 1891'de Henri Moissan tarafından flor gazı içinde katı iyot yakılarak sentezlendi. Bu ekzotermik reaksiyon, reaksiyon koşulları iyileştirilmiş olmasına rağmen hala iyot pentaflorür üretmek için kullanılır. I2 + 5 F2 → 2 IF5

Arsenöz asit (veya arsenik oksit), H3AsO3 formülüne sahip bir inorganik bileşiktir. Sulu çözeltilerde meydana geldiği bilinmektedir, ancak bu gerçek As(OH)3'ün öneminden uzaklaşmasa da saf bir malzeme olarak izole edilmemiştir.

Bromöz asit, HBrO2 formülüne sahip bir inorganik bileşiktir. Konjugat bazının -bromitlerinin- tuzları izole edilmiş olmasına rağmen, kararsız bir bileşiktir. Asidik çözeltide, bromitler broma ayrışır.

Çinko oksit, ZnO formülü ile gösterilen bir inorganik bileşik. ZnO, suda çözünmeyen beyaz bir tozdur ve yaygın olarak kauçuk, plastik, seramik, cam, çimento, yağlayıcı, boya, merhem, yapıştırıcı, sızdırmazlık maddesi, pigment, yiyecekler, bataryalar, ferritler, yangın geciktiriciler ve ilk yardım bantları gibi kullanım alanlarına sahiptir. Mineral çinkoit, doğal olarak meydana gelmesine rağmen, çoğu çinko oksit sentetik olarak üretilir.

Kurşun monoksit olarak da adlandırılan kurşun(II) oksit, PbO moleküler formülüne sahip inorganik bileşiktir. PbO iki polimorfda oluşur: tetragonal kristal yapıya sahip litarj ve ortorombik kristal yapıya sahip massikot. PbO için modern uygulamalar çoğunlukla kurşun bazlı endüstriyel cam ve, bilgisayar bileşenlerini de kapsayan endüstriyel seramiklerdir. Amfoterik bir oksittir.

Kimyada, oktahedral moleküler geometri, bir oktahedronun köşelerini tanımlayan, merkezi bir atom etrafında simetrik olarak düzenlenmiş altı atomlu bileşiklerin veya atom gruplarının veya ligandların şeklini tanımlar. Oktahedronun sekiz yüzü vardır, dolayısıyla octa ön ekini alır. Oktahedron, Platonik katılardan biridir, ancak oktahedral moleküller tipik olarak merkezlerinde bir atom içerir ve ligand atomları arasında bağ yoktur. Mükemmel bir oktahedron Oh nokta grubuna aittir. Oktahedral bileşiklerin örnekleri arasında kükürt hekzaflorür SF6 ve molibden hekzakarbonil Mo (CO)6 gösterilebilir. "Oktahedral" terimi, kimyagerler tarafından, merkezi atoma olan bağların geometrisine odaklanarak ve ligandların kendi aralarındaki farklılıkları dikkate almadan biraz gevşek bir şekilde kullanılır. Örneğin, N-H bağlarının oryantasyonu nedeniyle matematiksel anlamda oktahedral olmayan [Co(NH3)6]3+, oktahedral olarak adlandırılır.

Aktinit kimyası, aktinitlerin süreçlerini ve moleküler sistemlerini araştıran nükleer kimyanın ana dallarından biridir. Aktinitler, isimlerini grup 3 elementi olan aktinyumdan alır. Resmi olmayan kimyasal sembol An, aktinit kimyasının genel tartışmalarında herhangi bir aktinide atıfta bulunmak için kullanılır. Aktinidlerin biri hariç tümü, 5f elektron kabuğunun doldurulmasına karşılık gelen f blok elementleridir. Bir d-blok elementi olan lavrensiyum da genellikle bir aktinit olarak kabul edilir. Lantanitlerle karşılaştırıldığında, yine çoğunlukla f-blok elementleri, aktinitler çok daha değişken değerlik gösterirler. Aktinid serisi, aktiniyumdan lavrensiyuma kadar atom numaraları 89 ile 103 arasında değişen 15 metalik kimyasal elementi kapsar.
Demir (III) klorür FeCl
3 formüllü inorganik bir bileşiktir. Kristal bir katı olmasının yanı sıra görüş açısına bağlı olarak farklı renklerle gözlemlenebilir; koyu yeşil, mor-kırmızı. Sulu formu da katı formu da fiziksel görünüm olarak koyu kahverengi rengindedir.















