
Uranyum, radyoaktif bir kimyasal elementtir. Simgesi "U"dur. 1789 yılında Martin Heinrich Klaaproth tarafından keşfedilmiş ve 1841 yılında Eugene-Melchior Peligot tarafından izole edilmiştir. Uranyum ilk zamanda radyoaktivite ile ilgili fazla bilgi sahibi olunmadığından diğer elementler gibi zannedilse de, 1896 yılında bilim tarihinin önemli isimlerinden olan Dimitri Mendeleyev’in çalışmalarıyla radyoaktif bir element olduğu ispatlanmıştır.

Alkanlar, (diğer bir deyişle Parafinler) sadece karbon (C) ve hidrojen (H) elementlerinin bulunduğu ve bu elementlerin birbirleriyle tekli bağ yaptığı doymuş alifatik organik bileşiklerin genel ismidir. Alkanlar birbirlerini 1 karbon ve 2 hidrojen ile takip eden bir homolog seri oluştururlar. Örneğin tek karbonlu metan, CH4 formülüne sahipken, çift karbonlu etan C2H6 kapalı formülüne sahiptir. Alkanlarda tüm atomlar tekli bağlarla birbirlerine bağlandığı ve Karbon atomunu bağlayabileceği en fazla Hidrojen atomunu bağladığından dolayı doymuş bileşikler kategorisine girerler. Doymuş hidrokarbonlardan olan alkanlar, CnH2n+2 n=1,2,3,.... genel formülüne sahiptir. Burada n'in 3 veya 3'ten büyük olması hâlinde sikloalkan denilen halkalı yapılar oluşabilmektedirler.

Alkenler yapılarında en az bir tane karbon-karbon (C=C) çift bağı içeren organik bileşiklerdir. Alkenlerin yapısında karbon-karbon çift bağı bulunduğundan ve bu karbonların yapabileceği en fazla hidrojenle bağ yapmamış olduğundan alkenler doymamış bileşikler kategorisine girerler. Alkenlerin yapısında sadece bir karbon-karbon çift bağının bulunması durumunda homolog seriler oluşturur. Bu homolog serilerin genel formülü CnH2n şeklindedir. Burada n-in en az 2 olma şartı vardır. Aşağıda en basit alken olan eten, yaygın ismiyle etilenin, çeşitli modellemelerle çizilmiş şekillerinin yanı sıra alkenlerin çeşitli şekillerdeki yazılış şekilleri de bulunmaktadır.
Hidrojenasyon, bir kimyasal reaksiyon sınıfıdır ve organik bileşiklere hidrojen (H2) eklenmesi işlemidir. Hidrojenasyon, özellikle doymamış organik bileşikler (alkenler, alkinler, ketonlar ve nitriller ) için önemli bir reaksiyondur. Genellikle basınç altında katalizörler yardımı ile direkt hidrojen eklemesi ile gerçekleştirilir. Hidrojenasyon için en klasik örnek, alkenlerdeki doymamış karbon kimyasal bağına bir hidrojenin ekleyerek, alkeni alkana dönüştürmektir. İlaç ve petrokimya endüstrisinde çok değişik uygulamaları vardır. Bu kimyasal işlemin tersi dehidrojenasyondur. Alkenlere hidrojenin katılması sonucunda Alkanlar oluşur. Alkankar sadece karbon-karbon tekli bağlara sahiptirler. Bu tepkimede katalizör kullanıldığından katalitik hidrojenleme olarak da adlandırılır. Alkenlere hidrojen katılma tepkimeleri ekzotermik tepkimeler olup oda sıcaklığında katalizörsüz tepkime gerçekleşmez. Burada katalizör kullanılarak tepkimenin oda sıcaklığında gerçekleşmesi sağlanır. Yalnız katalizörün etkisi bununla sınırlı kalmıyor. Kullanılan katalizör elde edilecek olan ürünün cis-Alkan ya da trans-Alkan olmasını etkilemektedir. Eğer kullanılan katalizör heterojen bir katalizör ise, (bir parça nikel, platin, paladyum) yani çözelti içerisinde heterojen olarak karışıyorsa katılan her iki hidrojen atomu alkenin aynı tarafına eklenir ve böylece cis-Alkan oluşur. Şayet bu katalizör çözelti içerisinde homojen olarak yayılan bir katalkizörse bu seferde trans-Alkan oluşmuş olacak.

Friedrich Wöhler, Alman kimyager. Üreyi laboratuvarda sentezleyen ilk bilim insanıdır.

Ludwig Karl Martin Leonhard Albrecht Kossel Alman biyokimyacı ve genetik çalışmalarının öncüsü bilim insanı. Biyolojik hücrelerin genetik materyali olan nükleik asitlerin kimyasal bileşiminin belirlenmesinde yaptığı çalışmalarla 1910 yılında Nobel Fizyoloji veya Tıp Ödülü'nü kazandı.
Katılma tepkimeleri, bir organik molekülün yapısına dışarıdan başka bir molekülün katılmasıdır. Organik kimyada yapısında karbon-karbon çift bağı (Alken) ya da karbon-karbon üçlü bağı (Alkin) bulunduran molekülerlerin yapısına dışarıdan en az iki elementin girmesiyle gerçekleşen tepkimelerdir. İşte bu tepkimeler sonucu yapısında çoklu bağ bulunduran moleküldeki çoklu bağlar kırılarak yerlerine tekli bağlar oluşur.
Halojenleme veya halojenasyon, bir bileşiğe bir veya daha fazla halojenin katılmasını gerektiren kimyasal bir reaksiyondur. Alkenler, klor ve brom gibi halojenlerle, nükleofillik özelliği göstermeyen çözücüler içerisinde hızla tepkimeye girerler ve dihalojenleri oluştururlar. Bromun katılması daha kolay takip edilebilmektedir. Çünkü kırmızı-kahve rengi olan Brom çözeltisinin rengi ortadan kalkar. Bu yöntem özellikle çift bağların varlığını kanıtlamada kullanılır. Burada alken doymamış bir molekül olduğu için bromla tepkimeye girerken, alkanlar ise ortamda radikal bir çözelti olmadığı sürece tepkime vermez. Genel itibarıyla bu tepkimeler ya oda sıcaklığında ya da soğuk bir ortamda inert halojen çözücülerinin (CCl4) varlığında uygulanır.
Alkenler sülfürik asitin katılması soğuk bir ortamda bile tepkime verip Alkil hidrojen sülfat bileşiklerini vermektedir. Genel itibarıyla bu tepkime alkenlere hidrojen halojen katılma tepkimeleriyle benzerlik göstermektedir.

Alkinler, hidrokarbon zincirinde en az bir tane karbon-karbon üçlü bağı içeren organik bileşiklerdir. Yapısında sadece bir tane karbon-karbon üçlü bağı bulunduran alkinler, homolog bir sıra oluştururlar ve CnH2n-2 n=2,3,4... genel formülüne sahiptirler. En basit alkin asetilendir (C2H2, etin). Alkinlerin yapısında en az karbon–karbon üçlü bağı bulunduğundan ve moleküldeki karbonlar bağlıya bileceği en fazla hidrojen atomunu bağlamadıklarından doymamış moleküller kategorisine girerler. İlk kez en basit alkin, asetilen ünlü İngiliz kimyager Humphry Davy’in kuzeni olan Edmund Davy tarafından bulunmuştur.
Alkenler sülfürik asitin katılması soğuk bir ortamda bile tepkime verip Alkil hidrojen sülfat bileşiklerini vermektedir. Genel itibarıyla bu tepkime alkenlere hidrojen halojen katılma tepkimeleriyle benzerlik göstermektedir.
Alkilbenzenler, bir veya daha fazla hidrojen atomunun, farklı büyüklükteki alkil gruplarıyla değiştirildiği benzen türevleridir. Aromatik hidrokarbonların bir alt kümesidir. En basit üye, benzenin bir hidrojen atomunun bir metil grubu ile değiştirildiği toluendir.

Peroksitler, R−O−O−R yapısına sahip bir grup bileşiktir. Bir peroksit içindeki O−O fonksiyonel grubu, peroksit grubu veya perokso grubu olarak adlandırılır. Oksit iyonlarının aksine, peroksit iyonundaki oksijen atomları -1 yükseltgenme seviyesine sahiptir.
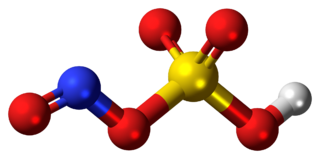
Nitrozilsülfürik asit, NOHSO4 formülüne sahip bir kimyasal bileşiktir. Endüstriyel olarak kaprolaktam üretiminde kullanılan renksiz bir katıdır. Daha önce sülfürik asit üretmek için öncü oda işleminin bir parçasıydı. Bileşik, sülfürik asit ve nitröz asidin karışık anhidritidir.
Nitrolama bir nitro grubunun organik kimyasal bileşik içine sokulması için genel bir kimyasal proses sınıfıdır. İfade daha genel olarak, ayrıca nitrogliserin sentezinde olduğu gibi alkoller ve nitrik asit arasında farklı nitrat esterleri oluşturma işlemine yanlış olarak uygulanır. Nitro bileşiklerinin ve nitratların ortaya çıkan yapısı arasındaki fark nitro bileşiklerindeki azot atomunun doğrudan oksijen olmayan bir atoma genel olarak da karbon veya başka azot atomuna bağlanmasıdır. Oysaki organik nitratlar olarak da adlandırılan nitrat esterlerinde, azot bir oksijen atomuna genellikle dolayısıyla da bir karbon atomu 'na bağlanır.
Dinitrobenzenler bir benzen halkası ve iki nitro grubu (-NO2) sübstitüentlerinden oluşan kimyasal bileşiklerdir. Nitro gruplarının üç olası düzenlemesi üç izomer; 1,2-dinitrobenzen, 1,3-dinitrobenzen ve 1,4-dinitrobenzen verir. Her izomerin kimyasal formülü C6H4N2O4 ve yaklaşık 168,11 g/mol bir mol kütlesi vardır. 1,3-Dinitrobenzen en yaygın izomerdir ve patlayıcıların üretiminde kullanılır.
1,2-Dinitrobenzen C6H4(NO2)2 formülüne sahip bir organik bileşiktir. Dinitrobenzenin üç izomerinden biridir. Bileşik, organik çözücüler içinde çözülebilen beyaz veya renksiz bir katıdır. 2-Nitroanilinden diazolama ve bir bakır katalizör eşliğinde sodyum nitrit ile muamele edilerek hazırlanır.
1,4-Dinitrobenzen C6H4(NO2)2 formülüne sahip bir organik bileşiktir. Dinitrobenzenin üç izomerinden biridir. 1,4-izomeri en simetriktir. Bileşik, organik çözücüler içinde çözülebilen sarı bir katıdır. 4-Nitroanilinden diazolama ve bir bakır katalizör eşliğinde sodyum nitrit ile muamele edilerek hazırlanır.

Nitro bileşikleri, bir veya daha fazla nitro fonksiyonel grubu (−NO2) içeren organik bileşiklerdir. Nitro grubu, dünya çapında kullanılan en yaygın eksplosoforlardan (bileşiği patlayıcı madde yapan fonksiyonel grup) biridir. Nitro grubuda güçlü bir elektron çeken gruptur. Bu özellik nedeniyle, nitro grubuna alfa (bitişik) olan C-H bağları asidik olabilir. Aynı nedenden dolayı, aromatik bileşiklerde nitro grubunun varlığı elektrofilik aromatik sübstitüsyonu yavaşlatsa da nükleofilik aromatik sübstitüsyonu kolaylaştırır. Nitro grupları, doğada nadiren bulunur ve nitrik asit ile başlayan nitrolama reaksiyonları tarafından neredeyse her zaman üretilir.

Nitrobenzen kimyasal formülü C6H5NO2 olan bir organik bileşiktir. Acıbadem benzeri bir kokuya sahip, suda çözünmeyen soluk sarı renkli bir yağdır. Donduğunda yeşilimsi sarı renkli kristallere dönüşür. Anilinin öncül maddesi olarak benzenden büyük ölçüde üretilir. Laboratuvarda, özellikle elektrofil reaktifler için, bazen bir çözücü olarak kullanılır.














