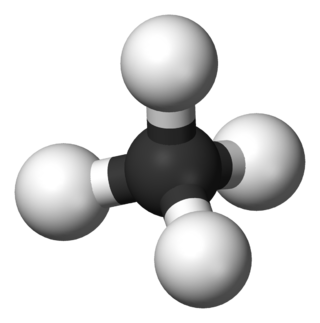
Hidrokarbon, sadece karbon ve hidrojen atomlarından oluşan kimyasal bileşiklerin genel adı.
Kemosentez, ışık enerjisi olmadan organik madde üretilmesidir. Gereken enerji; demir, kükürt, hidrojen veya azot gibi inorganik bileşiklerin veya metanın oksitlenmesiyle elde edilir.
Organik, "bitki veya hayvan kökenli", bazen de "karbon içeren" anlamında kullanılan bir sıfat. Organik sözcüğü ile şunlardan biri kastedilmiş olabilir:
- Kimyada, karbon içermekte olan organik bileşikler.
- Tarımda, organik kelimesi gübre ve böcek ilacı ile ilgilidir, bunların kesinlikle hayvan veya bitki kökenli olması gerekir. Kullanılan ürünlerin doğallığı sebebiyle Organik tarım olarak adlandırılır.
- Organik gıda, doğal beslenmede kullanılan çeşitli ürünler.
- Organik ürünler adı altında kullanıma sunulan veya satılan ürünlerdir.
- Organik restoran veya doğaya yakın anlamında organik yaşam biçimi şeklinde de kullanımları mevcuttur.
- Organik kozmetik - Organik tarım ile elde edilen sertifikalı organik bitkilerin özsuları kullanılarak üretilen kozmetik veya dermokozmetik ürünler.
- Organik yapım eşya, petrokimyasal ve insan yapımı malzemelerin kullanılmadığı anlamında gelir.
- Ayrıca organik terimi bir bütünün ayrılmaz parçalarından birisi anlamında da kullanılır.
- Organik (askeriye)

Alkanlar, (diğer bir deyişle Parafinler) sadece karbon (C) ve hidrojen (H) elementlerinin bulunduğu ve bu elementlerin birbirleriyle tekli bağ yaptığı doymuş alifatik organik bileşiklerin genel ismidir. Alkanlar birbirlerini 1 karbon ve 2 hidrojen ile takip eden bir homolog seri oluştururlar. Örneğin tek karbonlu metan, CH4 formülüne sahipken, çift karbonlu etan C2H6 kapalı formülüne sahiptir. Alkanlarda tüm atomlar tekli bağlarla birbirlerine bağlandığı ve Karbon atomunu bağlayabileceği en fazla Hidrojen atomunu bağladığından dolayı doymuş bileşikler kategorisine girerler. Doymuş hidrokarbonlardan olan alkanlar, CnH2n+2 n=1,2,3,.... genel formülüne sahiptir. Burada n'in 3 veya 3'ten büyük olması hâlinde sikloalkan denilen halkalı yapılar oluşabilmektedirler.

Çözünürlük, belli bir miktar çözünenin, belirli şartlar altında, spesifik bir çözücü içinde çözünmesidir. Çözücü akışkan solvent olarak adlandırılır ve birlikte çözeltiyi oluştururlar. Çözümlendirme işlemi solvasyon olarak adlandırılır.
İnorganik kimya veya anorganik kimya; organik olmayan, yani karbon-hidrojen bağı içermeyen bileşiklerin özelliklerini ve kimyasal davranışlarını inceleyen kimya dalı. Anorganik ve organik kimyayı birleştiren organometalik bileşikler, organometalik kimya adında başka bir dalı oluşturur.

Organik kimya, organik bileşiklerin ve organik maddelerin yani karbon atomlarını içeren çeşitli formlardaki maddelerin yapısını, özelliklerini ve reaksiyonların bilimsel çalışmasını içeren, kimyanın bir alt dalıdır. Yapının incelenmesi yapısal formüllerini belirler. Özelliklerin incelenmesi, fiziksel ve kimyasal özellikleri ve davranışlarını anlamak için kimyasal reaktivitenin değerlendirilmesidir. Organik reaksiyonların incelenmesi doğal ürünlerin, ilaçların ve polimerlerin kimyasal sentezini ve bireysel organik moleküllerin laboratuvarda ve teorik çalışma yoluyla incelenmesidir.

Organik bileşikler, molekülleri karbon içeren kalabalık kimyasal bileşikler sınıfındandır. Aşağıda sunulan tarihsel nedenlerden dolayı, bu bileşiklerin küçük bir kısmı, örneğin karbonatlar, basit karbon oksitleri ve siyanürlerin yanı sıra, karbon allotropları inorganik kabul edilir. "Organik" ve "inorganik" karbon bileşikleri arasındaki ayrım "kimyanın geniş alanını düzenlemek için yararlı olsa da, çoğunlukla rastgeledir".
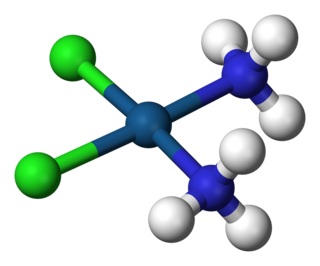
Kompleks, merkez atom olarak bir ya da birden fazla metal atomu veya iyonu ve metale bağlı ligandlardan oluşan yapıdır. Ligand, metale elektron vererek kompleks oluşturur. Metal içeren bileşiklerin birçoğu, özellikle geçiş metalleri içerenler koordinasyon bileşikleridir.
Organometalik kimya, metal içeren organik bileşiklerle ilgilenen bilim dalı. Genel olarak gösterimi R-Mg-X şeklindedir. Organometalik bileşikleri elde etmek için Mg ve susuz ortam vazgeçilmez iki özelliktir. Deney ortamında su buharının bulunması tepkimenin gerçekleşmesini engellediğinden çözücü olarak genellikle eter kullanılır.

İnorganik, organik olmayan anlamına gelir. Biyolojide su, mineral, asit, baz, tuzlar gibi canlıların yapısında bulunan ancak canlı olmayan veya bir canlı tarafından üretilmemiş bileşiklerdir. Kimyada inorganik bileşikler, sıklıkla karbon taşımayan moleküllerdir. Bunlara örnek olarak da, anyonlar veya katyonlar olarak sınıflandırılan çeşitli iyonik bileşikler ile kovalent bileşikleri verilebilir. Birçoğu iyonlardan meydana gelmiş olsa da kovalent bağlı inorganik bileşikler de bulunur. Karbon disülfür, karbonmonoksit ve siyanürler gibi karbon bileşikleri inorganik olarak kabul edilir.

Ksilen, benzene iki adet metil grubu bağlanmasıyla olusan bileşik. Disubstitue benzen olduğundan adlandırılması da benzerdir. Orto ksilen, meta ksilen ve para ksilen olmak üzere üç çeşittir. Toluenle akraba sayılır. Uçucu organik bileşiklerdendir. Zehirli, kanserojen bir bileşiktir.

Kimyada ayıraç, reaktif, reajan veya reaktant belli bir bileşik ile karakteristik bir reaksiyona girebilen ve bu sayede o bileşiğin varlığını hatta miktarını belirlemeye yarayan ve reaksiyondan ürün üretmeye yarayan bir bileşiktir. Analitik ayıraçlarin örnekleri arasında Fehling ayıracı ve Tollens ayıracı sayılabilir. Organik kimyada ayıraçlar birer bileşik veya karışım olabilirler, organik bir reaktanın değişime uğramasını neden olurlar. Organik ayıraçlara örnek olarak Collins ayıracı, Fenton ayıracı ve Grignard ayıracı gösterilebilirken katalizörler ayraç değildir.

Kurt Alder Nobel Ödülü sahibi Alman kimyager.
Organik reaksiyonlar, organik maddelerin tepkimelerine verilen genel addır.
Norbornan ya da bisiklo [2.2.1] heptan, C7H12 kimyasal formülüne sahip bir organik bileşik ve doymuş bir hidrokarbondur. Erime noktası 88 °C olan kristalin bir bileşiktir. Karbon iskeleti, 1,4-pozisyonunda bir metilen köprüsüne sahip sikloheksan halkasından türetilmiştir ve bir köprülü bisiklik bileşiktir. Bileşik, gerili bir bisiklik hidrokarbon sınıfının prototipidir.
Nitrolama bir nitro grubunun organik kimyasal bileşik içine sokulması için genel bir kimyasal proses sınıfıdır. İfade daha genel olarak, ayrıca nitrogliserin sentezinde olduğu gibi alkoller ve nitrik asit arasında farklı nitrat esterleri oluşturma işlemine yanlış olarak uygulanır. Nitro bileşiklerinin ve nitratların ortaya çıkan yapısı arasındaki fark nitro bileşiklerindeki azot atomunun doğrudan oksijen olmayan bir atoma genel olarak da karbon veya başka azot atomuna bağlanmasıdır. Oysaki organik nitratlar olarak da adlandırılan nitrat esterlerinde, azot bir oksijen atomuna genellikle dolayısıyla da bir karbon atomu 'na bağlanır.
Dinitrobenzenler bir benzen halkası ve iki nitro grubu (-NO2) sübstitüentlerinden oluşan kimyasal bileşiklerdir. Nitro gruplarının üç olası düzenlemesi üç izomer; 1,2-dinitrobenzen, 1,3-dinitrobenzen ve 1,4-dinitrobenzen verir. Her izomerin kimyasal formülü C6H4N2O4 ve yaklaşık 168,11 g/mol bir mol kütlesi vardır. 1,3-Dinitrobenzen en yaygın izomerdir ve patlayıcıların üretiminde kullanılır.
1,4-Dinitrobenzen C6H4(NO2)2 formülüne sahip bir organik bileşiktir. Dinitrobenzenin üç izomerinden biridir. 1,4-izomeri en simetriktir. Bileşik, organik çözücüler içinde çözülebilen sarı bir katıdır. 4-Nitroanilinden diazolama ve bir bakır katalizör eşliğinde sodyum nitrit ile muamele edilerek hazırlanır.

1,3-Dinitrobenzen C6H4(NO2)2 formülüne sahip bir organik bileşiktir. Dinitrobenzenin üç izomerinden biridir. Bileşik, organik çözücüler içinde çözülebilen sarı bir katıdır.














