
Karbon, doğada yaygın bulunan ametal kimyasal elementtir. Evrende bolluk bakımından altıncı sırada yer alan karbon, kızgın yıldızlarda hidrojenin termonükleer yanmasında temel rol oynar. Dünyada hem doğal halde, hem de başka elementlerle bileşik halinde bulunan karbon, ağırlık olarak Dünya'nın yerkabuğunun yaklaşık %0,2'sini oluşturur. En arı (katışıksız) biçimleri elmas ve grafittir; daha düşük arılık derecelerinde maden kömürünün, kok kömürünün ve odun kömürünün bileşeni olarak bulunur. Atmosferin yaklaşık % 0,05'ini oluşturan ve bütün doğal sularda erimiş olarak bulunan karbon dioksit, kireç taşı ve mermer gibi karbonat mineralleri, kömürün, petrolün ve doğalgazın başlıca yapıtaşları olan hidrokarbonlar, en bol bulunan bileşikleridir.
Atom ağırlığı ya da bağıl atom kütlesi, belirli bir örnekteki bir elementin atomlarının ortalama kütlesinin atomik kütle sabitine oranı olarak tanımlanan boyutsuz bir fiziksel niceliktir. Atomik kütle sabiti, bir karbon-12 atomunun kütlesinin 1/12'si olarak tanımlanır. Orandaki her iki miktar da kütle olduğundan, ortaya çıkan değer boyutsuzdur; dolayısıyla değerin göreceli (bağıl) olduğu ifade edilir.

Fotosentez, bitkiler ve diğer canlılar tarafından, ışık enerjisini organizmaların yaşamsal eylemlerine enerji sağlamak için daha sonra serbest bırakılabilecek kimyasal enerjiye dönüştürmek için kullanılan bir işlemdir. Bu kimyasal enerji, karbondioksit ve sudan sentezlenen şekerler gibi karbonhidrat moleküllerinde depolanır.

İzotoplar, periyodik tabloda aynı atom numarasına ve konuma sahip olan ve farklı nötron sayıları nedeniyle nükleon sayıları bakımından farklılık gösteren iki veya daha fazla atom türüdür. Belirli bir elementin tüm izotopları neredeyse aynı kimyasal özelliklere sahipken, farklı atomik kütlelere ve fiziksel özelliklere sahiptirler. İzotop terimi, "aynı yer" anlamına gelen Yunan kökenli isos ve topos 'den oluşur; isimin anlamı ise, tek bir elementin farklı izotoplarının periyodik tabloda aynı pozisyonda yer alması anlamına gelir. Margaret Todd tarafından 1913 yılında Frederick Soddy'ye öneri olarak sunulmuştur.

Bir ototrof, karbondioksit gibi basit maddelerden karbon kullanarak, genellikle ışıktan (fotosentez) veya inorganik kimyasal reaksiyonlardan (kemosentez) gelen enerjiyi kullanarak karmaşık organik bileşikler üreten bir organizmadır. Abiyotik bir enerji kaynağını organik bileşiklerde depolanan ve diğer organizmalar tarafından kullanılabilen enerjiye dönüştürürler. Ototroflar canlı bir karbon veya enerji kaynağına ihtiyaç duymazlar ve karadaki bitkiler veya sudaki algler gibi bir besin zincirindeki üreticilerdir. Ototroflar karbondioksiti indirgeyerek biyosentez için organik bileşikler ve depolanmış kimyasal yakıt yapabilirler. Çoğu ototrof indirgeyici madde olarak su kullanır, ancak bazıları hidrojen sülfür gibi diğer hidrojen bileşiklerini de kullanabilir.

Fermantasyon, hücre içinde oksijen yokluğunda meydana gelen metabolik bir faaliyet olarak ‘NAD+'yi yeniden oluşturmak için glikozun glikoliz yoluyla kısmi oksidasyonunu takip eden metabolik adımlar’ şeklinde tanımlanmaktadır. Fermantasyon anaerobik şartlarda, yani oksidatif fosforilasyon olamadığı durumlarda, glikoliz yoluyla ATP üretimini sağlayan önemli bir biyokimyasal süreçtir. Biyokimyanın fermantasyonla ilgilenen dalı zimolojidir.

Alkanlar, (diğer bir deyişle Parafinler) sadece karbon (C) ve hidrojen (H) elementlerinin bulunduğu ve bu elementlerin birbirleriyle tekli bağ yaptığı doymuş alifatik organik bileşiklerin genel ismidir. Alkanlar birbirlerini 1 karbon ve 2 hidrojen ile takip eden bir homolog seri oluştururlar. Örneğin tek karbonlu metan, CH4 formülüne sahipken, çift karbonlu etan C2H6 kapalı formülüne sahiptir. Alkanlarda tüm atomlar tekli bağlarla birbirlerine bağlandığı ve Karbon atomunu bağlayabileceği en fazla Hidrojen atomunu bağladığından dolayı doymuş bileşikler kategorisine girerler. Doymuş hidrokarbonlardan olan alkanlar, CnH2n+2 n=1,2,3,.... genel formülüne sahiptir. Burada n'in 3 veya 3'ten büyük olması hâlinde sikloalkan denilen halkalı yapılar oluşabilmektedirler.

Organik kimya, organik bileşiklerin ve organik maddelerin yani karbon atomlarını içeren çeşitli formlardaki maddelerin yapısını, özelliklerini ve reaksiyonların bilimsel çalışmasını içeren, kimyanın bir alt dalıdır. Yapının incelenmesi yapısal formüllerini belirler. Özelliklerin incelenmesi, fiziksel ve kimyasal özellikleri ve davranışlarını anlamak için kimyasal reaktivitenin değerlendirilmesidir. Organik reaksiyonların incelenmesi doğal ürünlerin, ilaçların ve polimerlerin kimyasal sentezini ve bireysel organik moleküllerin laboratuvarda ve teorik çalışma yoluyla incelenmesidir.

Aminler, amonyaktaki bir veya daha fazla hidrojen atomunun organik radikaller ile değiştirilmesi yöntemiyle türetilmiş organik bileşikler ve fonksiyonel gruplardır. Yapısal olarak aminler amonyağa benzerler, ama bir veya daha fazla hidrojen atomu, alkil veya aril gibi organik sübstitüentlerle yer değiştirmiştir. Bu kuralın önemli bir istisnası RC(O)NR2 tipi bileşiklerdir (C(O) karbonil grubuna karşılık gelir), bunlara amin yerine amid denir. Amidler ve aminlerin yapıları ve özellikleri farklı olduğu için bu ayrım kimyasal olarak önemlidir. Adlandırma açısında biraz akıl karıştırıcı olan bir nokta, bir aminin N-H grubunun N-M (M= metal) ile değişmesi hâlinde buna da amid denmesidir. Örneğin (CH3)2NLi, lityum dimetilamid'dir.

C4 karbon tutulumu mekanizması veya C4 bitkileri kara bitkilerinin fotosentezinde karbondioksiti bağlayan ve şeker oluşturan C3 karbon tutulumu mekanizması ve CAM bitkileri mekanizmaları gibi işleyen biyokimyasal mekanizmalardan biridir.
Klasik istatistik fizikte eşbölüşüm teoremi bir sistemin ortalama enerjisi ile sıcaklığı arasında ilişki kuran genel bir teoremdir. Eşbölüşüm teoremi ayrıca eşbölüşüm yasası, enerjinin eşbölüşümü veya basitçe eşbölüşüm olarak da bilinir. Eşbölüşümün temel düşüncesi, termal dengede enerjinin çeşitli formları arasında eşit olarak paylaşılmasıdır; örneğin bir molekülün öteleme hareketindeki ortalama kinetik enerjisi dönme hareketindeki ortalama kinetik enerjiye eşit olmalıdır.
Karbon döngüsü, ekosistemdeki canlıların yapısını oluşturan en önemli elementlerden biri karbondur. Karbon, canlılardaki bütün organik bileşiklerin yapısında bulunur.

"Biyolojik kömür" veya bilinen adıyla "mangal kömürü"; odunsu artıkların oksijensiz ortamda ısıl işlemle kömürleştirilmiş şeklidir. Mangal kömürü odun havasız veya oksijensiz ortamda 350 - 400 °C kadar ısıtılmasıyla kömürleşir.

Denitrifikasyon ya da nitrat solunumu, nitrat ve nitrit bileşiklerinin, anaerobik koşullarda mikroorganizmalar tarafından redüksiyona Uğratılarak elementer azota dönüştürülmesi olayı.

Kararlı izotop oranı kavramı durağan nükloid kavramına yakın bir anlama sahiptir. Durağan izotoplar; buharlaşma ve yoğunlaşma gibi fiziko-kimyasal proseslerle konsantrasyonları değişmesine rağmen zaman içinde değişmeyen izotoplardır. Yani duraylı (kararlı) izotoplar, radyoaktif bozulma göstermeyen izotoplardır. Fakat çoğul durağan izotop kavramı, genellikle belirli bir element üzerindeki nükleoidler üzerinde konuşulurken kullanılır. Bundan dolayı durağan izotoplar dediğimiz zaman üzerinde konuştuğumuz belirli elementin izotoplarından bahsediyor oluruz. Kısacası aynı elementin izotopları kastedilir. Birbiri ile bağıntılı bollukta olan buna benzer durağan izotoplar deneysel olarak “izotop analizi” yönetmi ile bulunabilmektedir. Bulunan bir izotop oranının bir deney aracı olarak kullanılması mümkündür. Teorik olarak, bu tarz durağan izotoplar “radyometrik tarihleme yöntemi” denilen yöntemde kullanılan ve bir radyoaktif bozulmanın ürünleri olan radyojenezik durumları içerebilirler. Ancak, kullanım olarak “durağan izotop oranı” dediğimizde genellikle kastedilen doğada kimin izotop fraksiyonlanmasının bolluğundan birbirine bağıl olarak etkilenip etkilenmediğini söylemektir.

Karbon tetraklorür ya da tetraklorometan, CCl4 formülüne sahip bir klorokarbon. Kokusu Kloroforma benzeyen, renksiz, yanıcı olmayan, sudan ağır bir sıvıdır. Suda çözünmezken birçok organik çözücü içinde çözünür. Geçmişte soğutucu gazların üretiminde, yangın söndürücülerde lav lambalarında, temizlik malzemesi ve kurt düşürücü olarak yaygın bir şekilde kullanılmıştır.
Kemotrof, içinde bulunduğu ortamdaki elektron vericisi/donörü moleküllerin oksidasyonu ile açığa çıkan elektronlardan enerji sağlayan canlıdır. Bu özellikleriyle kemotroflar, güneş enerjisini kullanarak fotosentez ile enerji elde eden fototroflardan ayrılırlar.
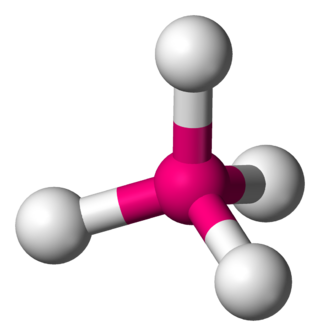
Dörtyüzlü veya tetrahedral molekül geometrisi, merkezi atomun, dört yüzlünün ortasında, dört köşede ise sübstitüentlerin yer aldığı molekül geometrisidir. Bağ açıları, dört sübstitüent aynı olduğunda (örn. metan CH4 ya da daha ağır analogları) cos−1 (-⅓) = 109,4712206 ...° ≈ 109.5° olur. Metan veya diğer simetrik yüzlü moleküller Td nokta grubuna aittir, ama dörtyüzlü moleküller genellikle düşük simetriye sahiptir. Tetrahedral moleküller kiral olabilir.
Karbon-karbon bağı, iki karbon atomu arasındaki kovalent bir bağdır. En yaygın şekli tekli bağdır: iki atomun her birinden birer tane olmak üzere iki elektrondan oluşan bir bağ. Karbon-karbon tekli bağı bir sigma bağıdır ve karbon atomlarının her birinden bir hibridize orbital arasında oluşur. Etanda orbitaller sp3-hibridize orbitallerdir, ancak diğer hibridizasyonlara sahip karbon atomları arasında oluşan tek bağlar meydana gelir. Aslında, tekli bağdaki karbon atomlarının aynı hibridizasyona sahip olması gerekmez. Karbon atomları ayrıca alken adı verilen bileşiklerde çift bağ veya alkin adı verilen bileşiklerde üçlü bağ oluşturabilir. Bir çift bağ, sp2-hibritleşmiş bir orbital ve hibritleşmeye dahil olmayan bir p-orbitali ile oluşturulur. Üçlü bağ, sp-hibritleşmiş bir orbital ve her atomdan iki p-orbitali ile oluşturulur. P-orbitallerinin kullanımı bir pi bağı oluşturur.

Karbon, Dünya üzerinde bilinen tüm yaşamın birincil bileşenidir ve tüm kuru biyokütlenin yaklaşık %45-50'sini temsil eder. Karbon bileşikleri Dünya'da doğal olarak bol miktarda bulunur. Karmaşık biyolojik moleküller, diğer elementlerle, özellikle oksijen ve hidrojenle ve sıklıkla nitrojen, fosfor ve kükürt ile bağlı karbon atomlarından oluşur.















