İzosiyanik asit
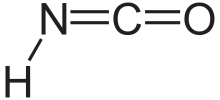 | |
 | |
| Adlandırmalar | |
|---|---|
İzosiyanik asit | |
Diğer adlar Karbimid[1] | |
| Tanımlayıcılar | |
CAS numarası | |
| ChEBI | |
| ChemSpider | |
| ECHA InfoCard | 100.109.068 |
PubChem CID | |
CompTox Bilgi Panosu (EPA) | |
| Özellikler | |
| Molekül formülü | HNCO |
| Molekül kütlesi | 43.03 g/mol |
| Görünüm | Renksiz sıvı ya da gaz |
| Yoğunluk | 1.14 g/cm3 (20 °C) |
| Erime noktası | −86 °C (−123 °F)[2] |
| Kaynama noktası | 23.5 °C (74.3 °F) |
| Çözünürlük (su içinde) | Erir |
| Çözünürlük | Benzen, toluen ve eter içinde çözünür |
| Tehlikeler | |
| İş sağlığı ve güvenliği (OHS/OSH): | |
| Ana tehlikeler | Zehirli |
| Aksi belirtilmediği sürece madde verileri, Standart sıcaklık ve basınç koşullarında belirtilir (25 °C [77 °F], 100 kPa). | |
İzosiyanik asit, 1830'da Liebig ve Wöhler tarafından keşfedilen HNCO formülüne sahip bir kimyasal bileşiktir.[3] Kaynama noktası 23.5 °C olan uçucu ve zehirli renksiz bir maddedir. İzosiyanik asit, organik kimya ve biyolojide en yaygın olarak bulunan dört element olan karbon, hidrojen, azot ve oksijen içeren en basit kararlı kimyasal bileşiktir.
Hazırlama ve reaksiyonlar
İzosiyanik asit, potasyum siyanat gibi tuzlardan, siyanat anyonunun gaz halinde hidrojen klorür veya oksalik asit gibi asitlerle protonlanmasıyla yapılabilir.[4]
- H+ + NCO- → HNCO
HNCO ayrıca bir trimer olan siyanürik asidin yüksek sıcaklıkta termal ayrışmasıyla da yapılabilir.
- C3H3N3O3 → 3 HNCO
İzosiyanik asit, karbondioksit ve amonyağa hidroliz eder:
- HNCO + H2O → CO2 + NH3
Yeterince yüksek konsantrasyonlarda, izosiyanik asit, siyanürik asit ve bir polimer olan siyamelit vermek üzere oligomerize olur. Bu türler genellikle sıvı veya gaz fazlı reaksiyon ürünlerinden kolayca ayrılır. Seyreltik izosiyanik asit çözeltileri atıl çözücülerde, örn. eter ve klorlu hidrokarbonlarda kararlıdır.[5]
İzosiyanik asit, üreler (karbamitler) vermek üzere aminler ile reaksiyona girer:
- HNCO + RNH2 → RNHC(O)NH2.
Bu reaksiyona karbamilasyon denir.
HNCO, karşılık gelen izosiyanatları vermek için vinileeterler gibi elektronca zengin çift bağları ekler.
İzosiyanik asit ayrıca dumanlı sis ve sigara dumanı da dahil olmak üzere çeşitli duman formlarında bulunur. Kütle spektrometresi kullanılarak tespit edildi ve suda kolayca çözünerek akciğerler için sağlık riski oluşturuyor.[6]
İzomerler: siyanik asit ve fülminik asit
HNCO içeren katıların düşük sıcaklıkta fotolizinin, siyanik asit veya hidrojen siyanat olarak bilinen H-O-C≡N yaptığı; izosiyanik asidin bir totomeridir.[7] Saf siyanik asit izole edilmemiştir ve tüm çözücülerde izosiyanik asit baskın formdur.[5]
Siyanik ve izosiyanik asitler, kararsız bir bileşik olan fulminik asidin (H-C=N-O) izomerleridir.[8]
Ayrıca bakınız
- Siyanat
- Tiyosiyanik asit
Kaynakça
- ^ Siyanamit de bu isme sahiptir ve bunun için daha sistematik olarak doğrudur
- ^ Pradyot Patnaik. Handbook of Inorganic Chemicals. McGraw-Hill, 2002, ISBN 0-07-049439-8
- ^ Liebig, J.; Wöhler, F. (1830). "Untersuchungen über die Cyansäuren" 6 Ağustos 2018 tarihinde Wayback Machine sitesinde arşivlendi.. Ann. Phys. 20 (11): 394. Bibcode:1830AnP....96..369L 6 Eylül 2019 tarihinde Wayback Machine sitesinde arşivlendi.. doi:10.1002/andp.18300961102.
- ^ Fischer, G.; Geith, J.; Klapötke, T. M.; Krumm B. (2002). "Synthesis, Properties and Dimerization Study of Isocyanic Acid" 5 Şubat 2012 tarihinde Wayback Machine sitesinde arşivlendi. (PDF). Z. Naturforsch. 57b (1): 19–25.
- ^ a b A. S. Narula, K. Ramachandran “Isocyanic Acid” in Encyclopedia of Reagents for Organic Synthesis, 2001, John Wiley & Sons, New York. doi:10.1002/047084289X.ri072m Article Online Posting Date: April 15, 2001.
- ^ Preidt, Robert. "Chemical in Smoke May Pose Health Risk". MyOptumHealth. AccuWeather. 21 Kasım 2011 tarihinde kaynağından arşivlendi. Erişim tarihi: 14 Eylül 2011.
- ^ Jacox, M.E.; Milligan, D.E. (1964). "Low-Temperature Infrared Study of Intermediates in the Photolysis of HNCO and DNCO". Journal of Chemical Physics. 40 (9): 2457–2460. Bibcode:1964JChPh..40.2457J 6 Eylül 2019 tarihinde Wayback Machine sitesinde arşivlendi.. doi:10.1063/1.1725546.
- ^ Kurzer, Frederick (2000). "Fulminic Acid in the History of Organic Chemistry". Journal of Chemical Education. 77 (7): 851–857. Bibcode:2000JChEd..77..851K 6 Eylül 2019 tarihinde Wayback Machine sitesinde arşivlendi.. doi:10.1021/ed077p851.
Dış bağlantılar
- Walter, Wolfgang (1997). Organic Chemistry: A Comprehensive Degree Text and Source Book 3 Ağustos 2020 tarihinde Wayback Machine sitesinde arşivlendi.. Chichester: Albion Publishing. p. 364. ISBN 978-1-898563-37-2. Erişim tarihi: 2008-06-21.
- Cyanic acid 9 Ağustos 2020 tarihinde Wayback Machine sitesinde arşivlendi. from NIST Chemistry WebBook (accessed 2006-09-09)