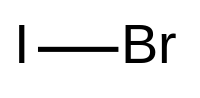Halojenler, periyodik tablonun 7A grubunda bulunan, tepkimeye eğilimli ametallerdir. Bu gruptaki elementlerin hepsinin elektronegatifliği yüksektir. Elektron alma eğilimi en yüksek olan elementlerdir. Doğada elementel olarak değil, mineraller halinde bulunurlar. Element halinde 2 atomlu moleküllerden oluşurlar. Oda koşullarında flor ve klor gaz, brom sıvı, iyotsa katı haldedir. Erime ve kaynama noktaları grupta aşağıdan yukarıya doğru azalır. Zehirli ve tehlikeli elementler olarak bilinirler. Halojenler metallerle reaksiyona girerek iyonik tuzları oluştururlar.
Ametal, metal özelliği göstermeyen elementlerdir. Isıyı ve elektrik akımını iletmek gibi metallere özgü özellikleri göstermezler. Ayrıca kendi aralarındaki ortak özellikleri yok denecek kadar azdır. Genellikle karbon, azot, fosfor, oksijen, kükürt, selenyum, flor, klor, brom, iyot ve soy gaz elementlerine ametal denir.

Klor, VIIA grubunda bulunan hafif, keskin kokulu, yeşilimsi sarı renkli, tahriş edici ve zehirleyici bir gaz. Havadan 2,5 kat ağır olan klor ilk zamanlar bir bileşik olarak kabul ediliyordu. Klor ilk olarak 1774 yılında Carl Wilhelm Scheele tarafından keşfedildi. 1810 yılında ise bugünkü ismi Humphry Davy tarafından verildi.

İyot, sembolü I, atom numarası 53 olan bir elementtir. Kimyasal olarak iyot halojenlerin en az reaktif olanı, astatin'den sonra en elektropozitif olanıdır. İyot başlıca tıpta, fotoğrafçılıkta ve boya imalatında kullanılır. Çoğu canlının eser miktarda iyota gereksinimi vardır.
Kimyasal formül, bir kimyasal birleşiği oluşturan atomlar hakkında detaylı ve açık bilgi veren bir yöntemdir. Moleküler bileşikler için, içindeki elementleri kimyasal sembolleriyle, o elementlerin sayısını da o atomun yanındaki sayılarla belirtirler. Eğer bir molekül, birden çok atom içeriyorsa, bu atomların nicelikleri, yanlarında altyazı olarak belirtilir. İyonik bileşikler ve moleküler olmayan maddeler içinse, atomların girdiği oranlar, bu altyazılarla belirtilir.

Sodyum hipoklorit, (NaClO) bir tür tuzdur. Günlük hayatta beyazlatıcı çamaşır sularında kullanılmaktadır. Oda koşullarındaki klor ile sabunlardaki sodyum hidroksit tepkimeye sokularak üretilmektedir.

Halojen lamba, iyot veya brom gibi az miktarda halojen içeren bir akkor lambadır. Halojen gazı ve tungsten filamenti kombinasyonu, bir halojen döngüsü kimyasal reaksiyonu üretir. Buharlaşan tungsten, filementin üzerine geri düşerek kimyasal reaksiyonun ömrünü arttırır ve zarfın netliğini korur. Bu nedenle bir halojen lamba, benzer güce ve kullanım ömrüne sahip standart bir gaz lambasından daha yüksek sıcaklıkta çalıştırılabilir ve daha yüksek ışık verimi ile renk sıcaklığına sahip ışık üretir. Halojen lambaların küçük boyutlu olması, projeksiyon ve aydınlatma için kompakt optik sistemlerde kullanılmasını mümkün kılar ve tasaruflu etki sağlar.

n-Heptan (C7H16), alkanlar sınıfından doymuş bir hidrokarbondur. Oda sıcaklığında sıvı hâldedir. Çözücü olarak sanayi ve laboratuvarlarda kullanılır. Yanıcıdır.

AuI, altın ve iyot elementlerinden oluşmuş bir kimyasal bileşiktir. Molekül ağırlığı 323.871 g/mol olan bu bileşik kapalı bir kapta altın ve iyotun 120 dereceye ısıtılarak 4 ay bekletilmesi sonucu sentezlenir. Sıcak su ile etkileşime girdiğinde ayrışır. Ancak bu bileşiğin diğer türevleri kimyasal olarak daha kararlıdır.

Potasyum iyodür kimyasal formülü KI olan inorganik bir bileşiktir. Bu beyaz tuz ticari olarak önemli bir iyot bileşiğidir. Sodyum iyodürden daha az higroskopik olmasından dolayı kullanımı daha kolaydır. Potasyum iyodür doğal olarak kelp içerisinde bulunur.

İyot triflorür IF3 kimyasal formüllü interhalojen bileşiktir. −28 °C'nin üzerinde bileşenlerine ayrılan sarı renkli bir katıdır. Kendisini oluşturan elementlerden sentezlenebilir fakat IF5 oluşumundan kaçınılmasına dikkat edilmelidir.

Hipoiyodöz asit, HOI kimyasal formülü ile gösterilen inorganik bir bileşiktir. Sulu bir iyot çözeltisinin cıva veya gümüş tuzları ile işlenmesi durumunda oluşur. Disproporsiyonlaşma ile hızla ayrışır:
- 5 HOI → HIO3 + 2I2 + 2H2O

İyot monoklorür ICl formülü ile gösterilen bir interhalojen bileşiktir. Oda sıcaklığına yakın eriyen kırmızı-kahverengi renge sahip bir kimyasal bileşiktir. İyot ve klorun elektronegatifliği arasındaki fark nedeniyle, ICl oldukça kutupsaldır ve I+ kaynağı olarak davranır.
İyot monoflorür, IF formülü ile gösterilen, iyot ve flordan oluşan bir interhalojen bileşiktir. 0 °C'de çikolata-kahverengi bir renge sahip katıdır, elementel iyot ve iyot pentaflorür'e disproporsiyonlaşır.
- 5 IF→ 2 I2 + IF5

İyodöz asit, HIO2 formülüne sahip kimyasal bileşiktir. Tuzları iyoditler olarak adlandırılır; oldukça kararsızdır ve hiçbir zaman izole edilmemiştir. Moleküler iyot ve iyodatlara hızlı şekilde ayrışır.
İyot pentaoksit I2O5 formülü ile gösterilen kimyasal bileşiktir. Bu iyot oksit, iyot asidinin anhidriti ve iyotun tek kararlı oksididir. 200 °C'de kuru hava akımında iyodik asidi kurutmak suretiyle üretilir:
- 2HIO3 → I2O5 + H2O
İyot pentafluorür, IF5 kimyasal formülüne sahip florür ve iyottan oluşan bir interhalojen bileşiktir. 3.250 g cm−3 yoğunluğa sahip, renksiz veya sarı bir sıvıdır. İlk olarak 1891'de Henri Moissan tarafından flor gazı içinde katı iyot yakılarak sentezlendi. Bu ekzotermik reaksiyon, reaksiyon koşulları iyileştirilmiş olmasına rağmen hala iyot pentaflorür üretmek için kullanılır. I2 + 5 F2 → 2 IF5

Astatin monoiyodür, AtI kimyasal formülüne sahip bir interhalojen bileşiktir.

Hidrojen iyodür (HI) iki atomlu bir molekül ve hidrojen halojenürdür. Sulu çözeltisi, güçlü bir asit olan hidroiyodik asit veya hidriyodik asit olarak bilinir. Bununla birlikte, hidrojen iyodür ve hidroiodik asit, birincisinin standart koşullar altında bir gaz olması, diğerinin ise söz konusu gazın sulu bir çözeltisi olması bakımından farklıdır. Birbirine dönüştürülebilir. HI, organik ve inorganik sentezlerde birincil iyot kaynaklarından biri ve bir indirgeyici madde olarak kullanılır.

Potasyum iyodat (KIO3) bir kimyasal bileşiktir. K+ ve IO3− iyonlarından oluşur. Potasyum iyodat oksitleyici bir maddedir ve bu nedenle yanıcı maddelerle temas ettiğinde yangına neden olabilir. Suda ve sülfürik asitte çözünür; alkolde çözünmez.