Soy gaz veya asal gaz, standart şartlar altında her biri, diğer elementlere kıyasla daha düşük kimyasal reaktifliğe sahip, kokusuz, renksiz, tek atomlu gaz olan kimyasal element grubudur. Helyum (He), neon (Ne), argon (Ar), kripton (Kr), ksenon (Xe) ve radon (Rn) doğal olarak bulunan altı soy gazdır ve tamamı ametaldir. Her biri periyodik tablonun sırasıyla ilk altı periyodunda, 18. grubunda (8A) yer alır. Grupta yer alan oganesson (Og) için ise önceleri soy gaz olabileceği ihtimali üzerinde durulsa da günümüzde metalik görünümlü reaktif bir katı olduğu öngörülmektedir.

İyot, sembolü I, atom numarası 53 olan bir elementtir. Kimyasal olarak iyot halojenlerin en az reaktif olanı, astatin'den sonra en elektropozitif olanıdır. İyot başlıca tıpta, fotoğrafçılıkta ve boya imalatında kullanılır. Çoğu canlının eser miktarda iyota gereksinimi vardır.

Kobalt kimyasal bir element'tir. Sembol'ü Co ve atom numarası 27'dir. Nikel gibi kobalt da, doğal meteorik demir alaşımlarında bulunan küçük birikintiler dışında, yer kabuğunda yalnızca kimyasal olarak birleşik formda bulunur. İndirgeyici eritme yoluyla üretilen serbest element sert, parlak, gümüş rengi bir metal'dir.
Astatin; simgesi At, atom numarası 85 olan radyoaktif bir elementtir. Yalnızca bazı ağır elementlerin bozunma ürünü olarak meydana gelir ve Dünya'nın yerkabuğunda doğal yollarla oluşan elementlerin en nadir olanıdır. En kararlı izotopu, 8,1 saatlik yarı ömre sahip astatin-210'dur. Kendi radyoaktivitesinin ürettiği ısı ile anında buharlaşmasından ötürü elementin saf bir örneği elde edilememiştir.
Ksenon, Xe sembolü ile gösterilen 54 atom numaralı kimyasal elementtir. Renksiz, ağır, kokusuz bir soy gaz olan ksenon Dünya atmosferinde eser miktarda bulunur. Genellikle reaktif olmayan element, sentezlenen ilk soy gaz bileşiği olan ksenon heksafloroplatinatın oluşumu gibi birkaç kimyasal reaksiyona maruz kalabilir.
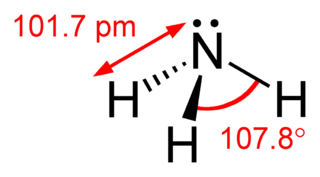
Amonyak, formülü NH3 olan; azot atomu ve hidrojen atomundan oluşan renksiz, keskin ve rahatsız edici kokulu bir bileşiktir. OH- iyonu içermediği hâlde suda zayıf baz özelliği gösterir. Bir amonyak molekülü, bir azot ve üç hidrojen atomundan oluşur. Oda sıcaklığında gaz hâlde bulunan bileşiğin ticari formu sulu çözeltiyi içermektedir.
Floroantimonik asit (HSbF6) hidrojen florür ve antimon pentaflorürün farklı oranlardaki karışımıdır. Bu karışımlardan 1:1 kombinasyonu, bilinen en güçlü süperasit formunu oluşturur. Öyle ki, bu form, hidrokarbonları iyonize ederek karbokatyonlar ve H2 oluşturabilmektedir.

Kripton diflorür, KrF2 kripton ve florun oluşturduğu kimyasal bileşiktir. Keşfedilen ilk kripton bileşiği olan kripton diflorür uçucu renksiz bir katıdır. KrF2'nin yapısı lineerdir ve Kr-F mesafesi 188,9 pm'dir. Güçlü Lewis asitleri ile reaksiyona girerek KrF+ ve Kr2F3+ katyon tuzlarını oluşturur. KrF2 en kolay ve en fazla üretilebilen kripton bileşiğidir. Oldukça güçlü bir oksitleyici ajan olan kripton diflorür, ksenonu ksenon hekzaflorüre veya iyotu iyot pentaflorüre dönüştürebilme kabiliyetine sahiptir. Bu oksidant özelliği ile florürleri ve altını oksitlemede kullanılır.

Ksenon diflorür, kimyasal formülü XeF2 olan güçlü bir florürleyici maddedir. En stabil ksenon bileşiklerinden biridir. Kovalent inorganik florürlerin birçoğu gibi neme duyarlıdır. Işık veya su buharı ile temas ettiğinde ayrışır. Ksenon diflorür, yoğun beyaz kristalli bir katıdır. Mide bulandırıcı kokuya ve düşük buhar basıncına sahiptir.
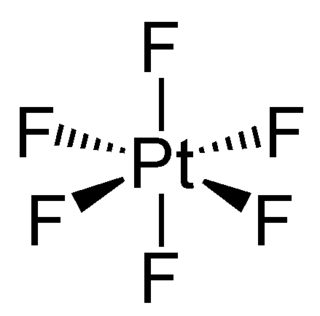
Platin hekzaflorür PtF6 formülüne sahip bileşiktir. Koyu kırmızı kristal kırmızı renkteki gaz formuna dönüşür. Bileşik, platinin +6 yükseltgenme seviyesi aldığı tek örnektir. D orbitallerindeki 4 elektron sayesinde bileşik paramanyetiktir. Bileşik kaliteli bir oksidan ve floritasyon maddesidir. Pt-F bağ uzunluğu 185 pikometredir.

İyot triflorür IF3 kimyasal formüllü interhalojen bileşiktir. −28 °C'nin üzerinde bileşenlerine ayrılan sarı renkli bir katıdır. Kendisini oluşturan elementlerden sentezlenebilir fakat IF5 oluşumundan kaçınılmasına dikkat edilmelidir.

Florokarbonlar, bazen perflorokarbon veya PFC olarak da anılır, CxFy formülüne sahip organoflor bileşikleridir. Sadece karbon ve flor içerirler fakat terminoloji her zaman çok sıkı takip edilmemektedir. Perfloro- ön ekine sahip bileşikler, heteroatomlu olanlar da dâhil olmak üzere hidrokarbonlardır, burada tüm C-H bağları C-F bağlarıyla değiştirilmiştir. Florokarbonlar perfloroalkanlar, floroalkenler ve floroalkinler ve perfloroaromatik bileşikler olabilir. Florokarbonlar ve bunların türevleri floropolimerler, soğutucular, çözücüler ve anestezikler olarak kullanılır.

İyot monoklorür ICl formülü ile gösterilen bir interhalojen bileşiktir. Oda sıcaklığına yakın eriyen kırmızı-kahverengi renge sahip bir kimyasal bileşiktir. İyot ve klorun elektronegatifliği arasındaki fark nedeniyle, ICl oldukça kutupsaldır ve I+ kaynağı olarak davranır.
İyot monoflorür, IF formülü ile gösterilen, iyot ve flordan oluşan bir interhalojen bileşiktir. 0 °C'de çikolata-kahverengi bir renge sahip katıdır, elementel iyot ve iyot pentaflorür'e disproporsiyonlaşır.
- 5 IF→ 2 I2 + IF5

İyot triklorür, iyot ve klordan oluşan bir interhalojen bileşiktir. Bu parlak sarı ve katı hâlde bir düzlemsel olarak mevcut olan dimer I2Cl6, iki köprü Cl atomlarına sahip Cl2I(μ-Cl)2ICl2 tir.
İyot pentaoksit I2O5 formülü ile gösterilen kimyasal bileşiktir. Bu iyot oksit, iyot asidinin anhidriti ve iyotun tek kararlı oksididir. 200 °C'de kuru hava akımında iyodik asidi kurutmak suretiyle üretilir:
- 2HIO3 → I2O5 + H2O
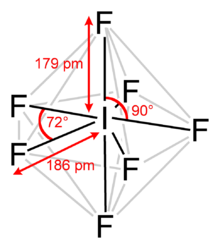
İyot pentafluorür, IF5 kimyasal formülüne sahip florür ve iyottan oluşan bir interhalojen bileşiktir. 3.250 g cm−3 yoğunluğa sahip, renksiz veya sarı bir sıvıdır. İlk olarak 1891'de Henri Moissan tarafından flor gazı içinde katı iyot yakılarak sentezlendi. Bu ekzotermik reaksiyon, reaksiyon koşulları iyileştirilmiş olmasına rağmen hala iyot pentaflorür üretmek için kullanılır. I2 + 5 F2 → 2 IF5

Potasyum sülfür K2S formülüne sahip inorganik bileşiktir. Potasyum sülfür suyla kolayca reaksiyona girip potasyum hidrosülfür (KHS) ve potasyum hidroksit (KOH) verdiğinden dolayı renksiz katı nadiren görülür. Yaygın olarak, potasyum sülfür ifadesi susuz katıyı değil de genel olarak bu karışımı ifade eder.
Dumas moleküler ağırlık belirleme yöntemi, bilinmeyen bir maddenin moleküler ağırlığını belirlemek için geçmişte kullanılan bir prosedürdü. Dumas yöntemi, oda sıcaklığında sıvı olan uçucu organik maddelerin moleküler ağırlıklarını belirlemek için uygundur.
Antimon pentaflorür, SbF5 formülüne sahip bir inorganik bileşiktir. Bu kokusuz, viskoz sıvı güçlü bir Lewis asididir ve sıvı HF ile sıvı SbF5'in 1:1 oranında karıştırılmasıyla oluşan süperasit floroantimonik asidin bir bileşenidir. Güçlü lewis asitliği ve neredeyse tüm bilinen bileşiklerle reaksiyona girme yeteneği ile dikkat çekicidir.