Ernest Rutherford, Yeni Zelandalı-İngiliz deneysel fizikçidir. 1908 yılı Nobel Kimya Ödülü sahibi.
Alkali metaller periyodik tablonun birinci grubunda yer alan metallerdir. Fransiyum dışında hepsi, yumuşak yapıda ve parlak görünümdedir.

Elektroliz; elektrik akımı yardımıyla, bir sıvı içinde çözünmüş kimyasal bileşiklerin ayrıştırılması işlemi. Bu değişiklik, maddenin elektron vermesinden (yükseltgenme); ya da almasından (indirgenme) kaynaklanır. Elektroliz işlemi, elektroliz kabı ya da tankı denen bir aygıt içinde uygulanır. Bu aygıt, çözünerek artı ve eksi yüklü iyonlara ayrılmış bir bileşiğin (→Elektrolit) içine birbirine değmeyecek biçimde daldırılmış iki elektrottan oluşur. Elektrotlar bir akım kaynağına bağlandığında meydana gelen gerilim, iyonları karşıt yüklü elektroda (kutup) doğru hareket ettirir. Karşıt kutupta yükünü dengeleyen atom veya moleküller elektrotta çökelir veya elektrolit içindeki moleküllerle yeni reaksiyonlara girer. Yeni reaksiyona girme meyli daha fazladır. Örneğin sofra tuzu içeren elektrolitte anotta klor açığa çıkarken nötr sodyum atomları su moleküllerini etkileyerek katottan hidrojen açığa çıkmasına sebep olurlar ve elekrolitte sodyum hidroksit oluşur.

Proton, atom çekirdeğinde bulunan artı yüklü atomaltı parçacıktır. Elektronlardan farklı olarak atomun ağırlığında hesaba katılacak düzeyde kütleye sahiptirler. Şimdiye kadar Protonların İki yukarı bir aşağı kuarktan oluştuğu kabul edilse de yeni yapılan bilimsel çalışmalarda araştırmacılar protonun kütlesinin yüzde 9'unun kuarkların ağırlığından, yüzde 32'sinin protonun içindeki kuarkların hızlı hareketlerinin meydana getirdiği enerjiden, yüzde 36'sının protonun kütlesiz parçacıkları olan ve kuarkları bir arada tutmaya yardımcı olan gluonların enerjilerinden, geriye kalan yüzde 23'lük bölümünse kuarkların ve gluonların protonun içinde karmaşık şekillerde etkileşimlerde bulunduklarında meydana gelen kuantum etkimelerden oluştuğunu buldular. Evrendeki bütün protonlar 1,6 x 10−19 değerinde pozitif yüke sahiptirler. Bu, atomlardaki çeşitli protonların birbirlerini itmelerini sağlar. Ama aradaki çekim, itmeden 100 kez daha güçlü olduğu için protonlar birbirlerinden ayrılmazlar. Protonun kütlesi elektronunkinden 1836 kat fazladır. Buna karşın, bilinmeyen bir nedenden ötürü elektronun yükü protonunkiyle aynıdır: 1,6 x 10−19 C. Atom içinde her biri (+1) pozitif elektrik yükü taşıyan taneciğe proton denir. Bu yüke yük birimi denir. Protonun yüklü elektronun yüküne eşit fakat ters işaretlidir.Bir protonun yoğunluğu yaklaşık olarak 4 x 1017 Kg/m³ 'tür. (2,5 x 1016 Lb/Ft3)

Elektrik akımı, elektriksel akım veya cereyan, en kısa tanımıyla elektriksel yük taşıyan parçacıkların hareketidir. Bu yük genellikle elektrik devrelerindeki kabloların içerisinde hareket eden elektronlar tarafından taşınmaktadır. Ayrıca, elektrolit içerisindeki iyonlar tarafından ya da plazma içindeki hem iyonlar hem de elektronlar tarafından taşınabilmektedir.

Parçacık hızlandırıcı, yüklü parçacıkları yüksek hızlara çıkarmak ve demet halinde bir arada tutmak için elektromanyetik alanları kullanan araçların genel adıdır. Büyük hızlandırıcılar parçacık fiziğinde çarpıştırıcılar olarak bilinirler. Diğer tip parçacık hızlandırıcılar, kanser hastalıklarında parçacık tedavisi, yoğun madde fiziği çalışmalarında senkrotron ışık kaynağı olmaları gibi birçok farklı uygulamalarda kullanılır. Şu an dünya çapında faaliyette olan 30.000'den fazla hızlandırıcı bulunmaktadır.

İyon ya da yerdeş, bir veya daha çok elektron kazanmış ya da yitirmiş bir atomdan oluşmuş elektrik yüklü parçacıktır. Atomlar kararsız yapılarından kurtulmak ve kararlı hale gelebilmek için elektron alırlar ya da kaybederler. Bunun için de başka bir atomla ya da kökle bağ kurarlar.
Pozitif ve negatif elektrik yük miktarının dengede olmadığı parçacıklara denir. Eğer pozitif yükler daha fazlaysa parçacık artı yüklü, negatif yükler daha fazlaysa parçacık eksi yüklüdür. Bu iki yükün birbirine eşit olması durumunda parçacık yüksüz veya nötrdür.

Thomson atom modeli, atomun yapısını tanımlayan birkaç bilimsel modelden biridir. Katot ışınlarının doğasını anlamaya çalışan İngiliz fizikçi Joseph John Thomson tarafından, elektronların parçacık olarak tanımlamasından kısa bir süre sonra atomun çekirdeğinin keşfinden önce 1904 yılında ortaya atıldı. Aynı zamanda üzümlü kek modeli olarak da bilinen bu model atomdaki negatif yüklü parçacıkların yerini ve atomların yüksüzlüğünü açıklamaktadır: Modele göre atomda pozitif yüklü bir gövdenin içinde bir kekin içindeki üzümler gibi negatif yüklü elektronlar homojen olarak dağılmıştır.

İyonik bağ, zıt yüklü iyonlar arasındaki elektrostatik kuvvetlere dayanan bir kimyasal bağ türüdür.

Kimyasal bağ, atomların veya iyonların molekülleri, kristalleri ve diğer yapıları oluşturmak üzere birleşmesidir. Bağ, iyonik bağlar'da olduğu gibi zıt yüklü iyonlar arasındaki elektrostatik kuvvetten veya kovalent bağ'larda olduğu gibi elektronların paylaşılmasından veya bu etkilerin bazı kombinasyonlarından kaynaklanabilir. Açıklanan kimyasal bağların farklı mukavemetleri vardır: kovalent, iyonik ve metalik bağlar gibi "güçlü bağlar" veya "birincil bağlar" ve dipol-dipol etkileşimleri, London dağılım kuvveti ve hidrojen bağı gibi "zayıf bağlar" veya "ikincil bağlar" vardır.
İyonlaşma enerjisi ya da iyonizasyon enerjisi, gaz halindeki bir atomun son temel enerji seviyesindeki çekirdek tarafından en az kuvvetle çekilen bir elektronu koparmak için verilmesi gereken en az enerji miktarıdır. Elementlerin elektron alış verişi sonucu oluşturdukları katyon ve anyonların oluşturduğu tepkimelerdir.Asitlerin iyonlaşması demek, kendini oluşturan (+) ve (-) yüklü iyonlarına ayrışması demektir.Asitler, saf haldeyken elektrik akımını iletemeyip sadece suda çözündüklerinde elektrik akımını iletebilirler. Mesela;

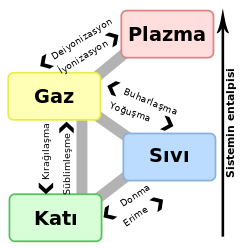
Plazma, gaz hâldeki maddelerin manyetik kutuplaştırmaya bağlı doğrusal noktalarda oluşan fiziksel ve kimyasal tepkimenin kontrollü etkileşim sürecine verilen genel ad. Daha kolay bir tanımla; atomun elektronlardan arınmış hâlidir.

Enerji seviyesi, atom çekirdeğinin etrafında katman katman biçiminde bulunan kısımların her biridir. Bu yörüngelerde elektronlar bulunur. Yörüngenin numarası; 1, 2, 3, 4, ... gibi sayı değerlerini alabilir. Yörünge numarasına baş kuantum sayısı da denir ve "n" ile gösterilir. Yörünge numarası ile yörüngenin çekirdeğe uzaklığı doğru orantılıdır.
Elektriksel iletkenlik iletken bir malzemeye uygulanan elektriksel alan etkisinde yük taşıyıcılarının uzak mesafeli hareketleri sonucu oluşur. Dört tür yük taşıyıcısı vardır.
- Elektronlar
- Yayınan katyon
- Yayınan anyon
- Elektron deliği

İyonizasyon derecesi, örneğin gaz ya da sulu çözeltilerdeki nötr parçacıkların, yüklü parçacıklara iyonize olmasının oranına denir. Düşük iyonizasyon derecesine kısmi iyonizasyon ve yüksek iyonizasyon derecesine de tam iyonizasyon adı verilir.
Franck–Hertz deneyi tarihsel önemi olan bir fizik deneyidir. Kuantum mekaniğine öncülük eden Bohr-atom-modeli, bu deney tarafından doğrulanmıştır. Alman fizikçiler James Franck ve Gustav Ludwig Hertz, 1914 yılında atomların enerji seviyelerini deneysel olarak ölçtüler. Böylece, Niels Bohr tarafından geliştirilen, elektronların atom çekirdekleri etrafında kesintili enerji yörüngelerinde yer aldığı atom modeli Franck–Hertz deneyi tarafından deneysel olarak kanıtlanmış oldu. Franck ve Hertz bu başarılarında dolayı 1925 yılında Nobel fizik ödülünü kazandılar.
Elektron ilgisi, genel olarak değerlik elektron sayıları 5, 6 ve 7 olan atomların elektron alarak s2p6 kararlı elektron düzenine ulaşmaları sırasında bir atomun diğer atoma ne kadar sağlam bağlandığını gösterir ve bağlanma esnasında ortaya çıkan enerjidir. Bu ekzotermik olayda dışarıya verilen enerji, mesela gaz hâlindeki yüksüz bir atomun elektron kazanarak (-1) yüklü iyon (anyon) hâle gelmesi sırasında açığa çıkar.

Elektrik arkı, gazların kıvılcım anında ortaya çıkması ile oluşan elektrik olayı. Akım iletken olmayan hava tarafından iletildiği anda elektriksel ark oluşur. Ark boşalması voltajı az olan taraftan gözlenebilir. Elektriksel ark kavramının gözlenebilmesi için elektrotlar tarafından desteklenmelidir. Ayrıca, elektriksel ark kavramı elektrotlardaki elektronların termiyonik emisyonlarına bağlıdır. Voltaik ark terimi ise voltaik ark lambalarında kullanılır.

Korona deşarjı; yüksek gerilimli bir iletkenin, etrafını saran hava gibi akışkanların iyonlaşmasıyla oluşan elektriksel bir deşarjdır. Havanın elektriksel bir kırılım geçirip iletkenleşmesi ve yükün iletkenden akışkana sızmasını sağlar. Korona deşarjı, iletkenin etrafındaki elektrik alanın, havanın dielektrik dayanımını aştığı yerlerde oluşur. Genellikle nemli ve sisli havalarda görülen bu deşarj işlemi radyal olarak dışarıya mor renkli ışık halkaları emite eder. Kendiliğinden meydana gelen korona deşarjı doğal olarak eğer elektrik alanı şiddetinin limiti sonsuza gitmiyorsa yüksek voltajlı sistemlerde açığa çıkar. Genellikle yüksek voltaj taşıyan iletkenlerin havaya bitişik sivri noktalarında, mavimsi bir parıltı olarak görülür ve bir gaz deşarj lambasıyla aynı özellikte ışık yayar.