İyodometan
 | |||
| |||
| Adlandırmalar | |||
|---|---|---|---|
Sistematik IUPAC adı iyodometan | |||
Diğer adlar Metil iyodür[1] | |||
| Tanımlayıcılar | |||
CAS numarası | |||
| Kısaltmalar | MeI, Halon 10001 | ||
| ECHA InfoCard | 100.000.745 | ||
| EC Numarası |
| ||
PubChem CID | |||
CompTox Bilgi Panosu (EPA) | |||
| Özellikler | |||
| Kimyasal formül | CH3I | ||
| Molekül kütlesi | 141,94 g mol−1 | ||
| Görünüm | renksiz sıvı | ||
| Yoğunluk | 2.28 g·mL−1 | ||
| Erime noktası | −66.5 °C; −87.6 °F; 206.7 K | ||
| Kaynama noktası | 42.4~42.8 °C; 108.2~108.9 °F; 315.5~315.9 K | ||
| Çözünürlük (su içinde) | 14 g·L−1 (20 °C, 68 °F)[2] | ||
| Tehlikeler | |||
| NFPA 704 (yangın karosu) | |||
| Aksi belirtilmediği sürece madde verileri, Standart sıcaklık ve basınç koşullarında belirtilir (25 °C [77 °F], 100 kPa). | |||
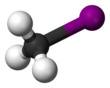
Metil iyodür olarak da adlandırılan ve genellikle "MeI" olarak kısaltılan iyodometan, CH
3I formülüne sahip kimyasal bileşiktir. Yoğun, renksiz, uçucu bir sıvıdır. Kimyasal yapı açısından, metan molekülündeki bir hidrojen atomunun bir iyot atomu ile değiştirilmiş hâli olarak görülebilir. Pirinç tarlaları tarafından küçük miktarlarda doğal olarak salınır.[3] Ayrıca, dünyanın ılıman okyanuslarında algler ve yosunlar tarafından yılda 214.000 tondan fazla olduğu tahmin edilen büyük miktarlarda ve karasal mantarlar ve bakteriler tarafından karada daha az miktarlarda üretilir. Organik sentezlerde metil gruplarının kaynağı olarak kullanılır.
İyodometan ve diğer organik iyot bileşikleri, ciddi bir nükleer kaza koşulları altında oluşabilir.[4] Hem Çernobil hem de Fukuşima'dan sonra, sırasıyla Avrupa ve Japonya'da organik iyot bileşiklerinde iyot-131 tespit edilmiştir.[5][6]
Birçok organoiyodür bileşiği gibi, iyodometan da tipik olarak ışığın iyot vermesine neden olan bozunmayı engellemek için koyu renkli şişelerde saklanır Bozunmuş numunelerin morumsu bir rengi. Ticarî numuneler bakır veya gümüş tel ile stabilize edilebilir.
Elde edilişi
İyodometan, metanol ve kırmızı fosfor karışımına iyot eklendiğinde meydana gelen ekzotermik reaksiyon yoluyla oluşur.[7] İyotlama reaktifi, yerinde oluşan fosfor triiyodürdür:
Alternatif olarak, kalsiyum karbonat varlığında dimetil sülfatın potasyum iyodür ile reaksiyonundan hazırlanır:[7]
- (CH3O)2SO2 + KI → CH3I + CH3OSO2OK
İyodometan, metanolün sulu hidrojen iyodür ile reaksiyonuyla da hazırlanabilir:
- CH3OH + HI → CH3I + H2O
Elde edilen iyodometan, damıtma yoluyla ayrılabilir.
Kullanımları
Pestisit olarak
İyodometan ayrıca bir fungusit, herbisit, insektisit, nematisit olarak ve bir toprak dezenfektanı olarak, Montreal Protokolü kapsamında yasaklanan metil bromürün (bromometan olarak da bilinir) yerine kullanılması önerilmiştir. Arysta LifeScience tarafından üretilen ve "MIDAS" adı altında satılan iyodometan, ABD, Meksika, Fas, Japonya, Türkiye ve Yeni Zelanda'da pestisit olarak tescil edilmiştir ve Avustralya, Guatemala, Kosta Rika, Şili, Mısır, İsrail, Güney Afrika ve diğer ülkelerde ise kullanım onayı beklemededir.[8]
Metilleyici olarak
İyodometan, SN2 ikâme reaksiyonları için mükemmel bir substrattır. Nükleofillerin saldırısına sterik olarak açıktır ve iyodür iyi bir ayrılma grubur. Karbon, oksijen, kükürt, nitrojen ve fosfor nükleofillerini alkillemek için kullanılır.[9] Ne yazık ki, daha yüksek bir eşdeğer ağırlığa sahiptir: bir mol iyodometan, bir mol klorometanın neredeyse üç katı ve bir mol bromometanın yaklaşık 1,5 katıdır. Öte yandan, klorometan ve bromometan gaz hâlindedir, bu nedenle kullanılması daha zordur ve ayrıca daha zayıf alkile edici maddelerdir.
İyodürler genellikle daha yaygın klorürler ve bromürlere göre daha pahalıdır, ancak iyodometan makul ölçüde karşılanabilir olmasına rağmen, ticarî ölçekte, ucuz olduğu ve daha yüksek kaynama noktasına sahip olduğu için daha toksik olan dimetil sülfat tercih edilir. İyodometandaki iyodür ayrılma grubu, istenmeyen yan reaksiyonlara neden olabilir. Son olarak, oldukça reaktif olan iyodometan, laboratuvar çalışanları için benzer klorür ve bromürlerden daha tehlikelidir.
Örneğin, karboksilik asitlerin veya fenollerin metilasyonu için kullanılabilir:[10]
Toksisite
Amerika Birleşik Devletleri Tarım Bakanlığı'na göre iyodometan, soluma ve yutma için orta ila yüksek akut toksisite sergiler.[11] Hastalık Kontrol ve Önleme Merkezleri (CDC), gözlerin, cildin, solunum sisteminin ve merkezî sinir sisteminin hedef organlar olarak ve olası maruz kalma yolları olarak solumayı, cilt emilimini, yutmayı ve göz temasını listeler. Semptomlar arasında göz tahrişi, mide bulantısı, kusma, baş dönmesi, ataksi, geveleyerek konuşma ve dermatit sayılabilir.[12] Yüksek doz akut toksisitede, endüstriyel kazalarda meydana gelebileceği gibi, toksisite, karakteristik bir beyin hasarı paterni ile metabolik rahatsızlık, böbrek yetmezliği, venöz ve arteriyel tromboz ve nöbetler ve koma ile ensefalopatiyi içerir.[13]
Uluslararası Kanser Araştırma Ajansı (IARC), metil iyodürün Proposition 65'te listelenmesinden sonra yapılan çalışmalara dayanarak şu sonuca varmıştır: "Metil iyodür, insanlar için kanserojen olarak sınıflandırılamaz (Grup 3)."
Kaynakça
- ^ a b "Front Matter". Nomenclature of Organic Chemistry : IUPAC Recommendations and Preferred Names 2013 (Blue Book). Cambridge: The Royal Society of Chemistry. 2014. s. 657. doi:10.1039/9781849733069-FP001. ISBN 978-0-85404-182-4.
- ^ GESTIS ZVG=28110
- ^ K. R. Redeker; N.-Y. Wang; J. C. Low; A. McMillan; S. C. Tyler; R. J. Cicerone (2000). "Emissions of Methyl Halides and Methane from Rice Paddies". Science. 290 (5493): 966-969. Bibcode:2000Sci...290..966R. doi:10.1126/science.290.5493.966. PMID 11062125. 16 Mayıs 2022 tarihinde kaynağından arşivlendi. Erişim tarihi: 7 Haziran 2023.
- ^ St. John Foreman, Mark Russell (2015). "An introduction to serious nuclear accident chemistry". Cogent Chemistry. 1. doi:10.1080/23312009.2015.1049111
 .
. - ^ Bihari, Árpád; Dezső, Zoltán; Bujtás, Tibor; Manga, László; Lencsés, András; Dombóvári, Péter; Csige, István; Ranga, Tibor; Mogyorósi, Magdolna; Veres, Mihály (2014). "Fission products from the damaged Fukushima reactor observed in Hungary" (PDF). Isotopes in Environmental and Health Studies. 50 (1): 94-102. doi:10.1080/10256016.2013.828717. PMID 24437973. 6 Ekim 2022 tarihinde kaynağından arşivlendi (PDF). Erişim tarihi: 7 Haziran 2023.
- ^ Noguchi, Hiroshi; Murata, Mikio (1988). "Physicochemical speciation of airborne 131I in Japan from Chernobyl". Journal of Environmental Radioactivity. 7: 65-74. doi:10.1016/0265-931X(88)90042-2.
- ^ a b "METHYL IODIDE". Organic Syntheses.; Collective Volume, 2, s. 399
- ^ "Iodomethane Approved in Mexico and Morocco". Business Wire. 25 Ekim 2010. 25 Kasım 2018 tarihinde kaynağından arşivlendi. Erişim tarihi: 25 Kasım 2018.
- ^ Sulikowski, Gary A.; Sulikowski, Michelle M.; Haukaas, Michael H.; Moon, Bongjin (2005). "Iodomethane". Encyclopedia of Reagents for Organic Synthesis. e-EROS. doi:10.1002/047084289X.ri029m.pub2. ISBN 978-0471936237.
- ^ Avila-Zárraga, J. G.; Martínez, R. (January 2001). "Efficient methylation of carboxylic acids with potassium hydroxide/methyl sulfoxide and iodomethane". Synthetic Communications. 31 (14): 2177-2183. doi:10.1081/SCC-100104469.
- ^ Guo, Mingxin; Gao, Suduan (2009). "Degradation of Methyl Iodide in Soil: Effects of Environmental Factors" (PDF). Journal of Environmental Quality. 38 (2): 513–519. doi:10.2134/jeq2008.0124. PMID 19202021. 14 Ağustos 2011 tarihinde kaynağından (PDF) arşivlendi.
- ^ "CDC - NIOSH Pocket Guide to Chemical Hazards - Methyl iodide". cdc.gov. 6 Ekim 1999 tarihinde kaynağından arşivlendi. Erişim tarihi: 25 Haziran 2016.
- ^ Iniesta, Ivan; Radon, Mark; Pinder, Colin (2013). "Methyl iodide rhombencephalopathy: clinico-radiological features of a preventable, potentially fatal industrial accident". Practical Neurology. 13 (6): 393-395. doi:10.1136/practneurol-2013-000565. PMID 23847234. 22 Mart 2023 tarihinde kaynağından arşivlendi. Erişim tarihi: 7 Haziran 2023.