Asit, pH derecesi 7'den düşük olup, değişen oranlarda yakıcı ve/veya aşındırıcı özelliğe sahip olan ve oldukça geniş kullanım alanına sahip kimyasal maddelere verilen isimdir. Suda çözündüklerinde hidrojen iyonu derişimini artırarak çözeltiyi asidik yapar. Mavi turnusol kâğıdının rengini kırmızıya çeviren asitlere eski Türkçede hamız veya ekşit denir.

Klor, VIIA grubunda bulunan hafif, keskin kokulu, yeşilimsi sarı renkli, tahriş edici ve zehirleyici bir gaz. Havadan 2,5 kat ağır olan klor ilk zamanlar bir bileşik olarak kabul ediliyordu. Klor ilk olarak 1774 yılında Carl Wilhelm Scheele tarafından keşfedildi. 1810 yılında ise bugünkü ismi Humphry Davy tarafından verildi.

İyot, sembolü I, atom numarası 53 olan bir elementtir. Kimyasal olarak iyot halojenlerin en az reaktif olanı, astatin'den sonra en elektropozitif olanıdır. İyot başlıca tıpta, fotoğrafçılıkta ve boya imalatında kullanılır. Çoğu canlının eser miktarda iyota gereksinimi vardır.
Hidrojen klorür ya da Kloran, HCl formülüne sahip renksiz, zehirli bir gazdır. Hidrojen ve klor elementlerin oluşan inorganik bileşiktir. Havadaki nem ile temasında beyaz hidroklorik asit dumanı oluşturur. Hidroklorik asit, hidrojen klorürün sulu çözeltisine verilen addır.

Kral suyu, asitlerin az etki ettiği ya da etki etmediği altın ve platin gibi metallerle tepkimeye girebilen kuvvetli bir asit çözeltisidir. Hidroklorik asit ve nitrik asitin 3:1 oranında karıştırılmasıyla oluşur. Ebu Musa Câbir bin Hayyan tarafından bulunduğu tahmin edilmektedir.
İyonlaşma enerjisi ya da iyonizasyon enerjisi, gaz halindeki bir atomun son temel enerji seviyesindeki çekirdek tarafından en az kuvvetle çekilen bir elektronu koparmak için verilmesi gereken en az enerji miktarıdır. Elementlerin elektron alış verişi sonucu oluşturdukları katyon ve anyonların oluşturduğu tepkimelerdir.Asitlerin iyonlaşması demek, kendini oluşturan (+) ve (-) yüklü iyonlarına ayrışması demektir.Asitler, saf haldeyken elektrik akımını iletemeyip sadece suda çözündüklerinde elektrik akımını iletebilirler. Mesela;

Hidroklorik asit, hidrojen ve klor elementlerinden oluşan, oda sıcaklığı ve normal basınçta gaz hâlinde olan hidrojen klorürün sulu çözeltisine verilen ad. Halk arasında tuz ruhu olarak da bilinir. 9. yüzyılda simyacı Câbir bin Hayyân tarafından keşfedildi ve sonrasında simya alanında kullanıldı. Sanayi Devrimi sırasında, sanayideki önemi keşfedilen asit, önce Leblanc işlemi, sonrasında Solvay işlemi ile sanayi alanında üretilmeye başladı. Hidroklorik asit, tarihte yeni kolaylıkların keşfinde önemli roller üstlendi. Günümüzde PVC'den demir-çeliğe, organik madde üretiminden gıda sektörüne kadar hemen hemen tüm alanlarda hidroklorik asit kullanılmaktadır.

Sodyum hipoklorit, (NaClO) bir tür tuzdur. Günlük hayatta beyazlatıcı çamaşır sularında kullanılmaktadır. Oda koşullarındaki klor ile sabunlardaki sodyum hidroksit tepkimeye sokularak üretilmektedir.

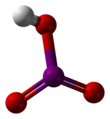
Klorik asit (HClO3), klorun bir oksoasiti ve klorat tuzlarının formal öncülüdür. Güçlü bir asit (pKa ≈1) ve oksitleyici ajandır.

Sodyum iyodat, (NaIO3) iyodik asitin sodyum tuzudur. Sodyum iyodat oksitleyici madde olduğundan, yanıcı maddeler ya da indirgeyici maddelerle temas ettiğinde alev almalarına sebep olabilir.

Kalay(II) klorür ya da stanit klorür, SnCl2 formülüne sahip, beyaz kristal halinde bir katıdır. Kararlı bir dihidrat oluşturur, ancak sulu çözeltileri, özellikle sıcaksa, hidrolize uğrama eğilimindedir. SnCl2 yaygın bir şekilde indirgeyici madde (bir asit çözeltisi içinde) olarak ve kalay kaplamada elektrolitik banyolarda kullanılır. Kalay (II) klorür, diğer kalay klorür (kalay(IV) klorür (SnCl4) ile karıştırılmamalıdır.

Hipoiyodöz asit, HOI kimyasal formülü ile gösterilen inorganik bir bileşiktir. Sulu bir iyot çözeltisinin cıva veya gümüş tuzları ile işlenmesi durumunda oluşur. Disproporsiyonlaşma ile hızla ayrışır:
- 5 HOI → HIO3 + 2I2 + 2H2O

İyot monoklorür ICl formülü ile gösterilen bir interhalojen bileşiktir. Oda sıcaklığına yakın eriyen kırmızı-kahverengi renge sahip bir kimyasal bileşiktir. İyot ve klorun elektronegatifliği arasındaki fark nedeniyle, ICl oldukça kutupsaldır ve I+ kaynağı olarak davranır.
İyot pentaoksit I2O5 formülü ile gösterilen kimyasal bileşiktir. Bu iyot oksit, iyot asidinin anhidriti ve iyotun tek kararlı oksididir. 200 °C'de kuru hava akımında iyodik asidi kurutmak suretiyle üretilir:
- 2HIO3 → I2O5 + H2O

Hidrojen iyodür (HI) iki atomlu bir molekül ve hidrojen halojenürdür. Sulu çözeltisi, güçlü bir asit olan hidroiyodik asit veya hidriyodik asit olarak bilinir. Bununla birlikte, hidrojen iyodür ve hidroiodik asit, birincisinin standart koşullar altında bir gaz olması, diğerinin ise söz konusu gazın sulu bir çözeltisi olması bakımından farklıdır. Birbirine dönüştürülebilir. HI, organik ve inorganik sentezlerde birincil iyot kaynaklarından biri ve bir indirgeyici madde olarak kullanılır.

Kloröz asit, HClO2 formülüne sahip bir inorganik bileşiktir. Zayıf bir asittir. Klor, bu asitte +3 oksidasyon durumuna sahiptir. Saf madde dengesiz, hipokloröz aside (Cl oksidasyon hali + 1) ve klorik aside (Cl oksidasyon hali + 5) orantısızdır:

Potasyum iyodat (KIO3) bir kimyasal bileşiktir. K+ ve IO3− iyonlarından oluşur. Potasyum iyodat oksitleyici bir maddedir ve bu nedenle yanıcı maddelerle temas ettiğinde yangına neden olabilir. Suda ve sülfürik asitte çözünür; alkolde çözünmez.

Sezyum klorür, CsCl formülüne sahip inorganik bileşiktir. Bu renksiz tuz, çeşitli uygulamalarda önemli bir sezyum iyonu kaynağıdır. Kristal yapısı, her bir sezyum iyonunun 8 klor iyonu ile koordine edildiği önemli bir yapısal tip oluşturur. Sezyum klorür suda çözünür.
Demir (III) klorür FeCl
3 formüllü inorganik bir bileşiktir. Kristal bir katı olmasının yanı sıra görüş açısına bağlı olarak farklı renklerle gözlemlenebilir; koyu yeşil, mor-kırmızı. Sulu formu da katı formu da fiziksel görünüm olarak koyu kahverengi rengindedir.

Baryum klorür, BaCl2 formüllü inorganik bir bileşik'tir. Bu bileşik baryum'un suda-çözünen en yaygın tuzlarından biridir. Diğer baryum tuzlarının çoğu gibi, baryum klorür beyaz toz halinde ve zehirlidir. Alevde sarı-yeşil renk verir. Ayrıca higroskopiktir, ilk önce dihidrat BaCl2(H2O)2' ye dönüşür.