İmmünoterapi
| İmmünoterapi | |
|---|---|
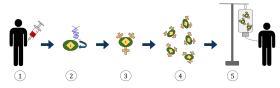 Yukarıdaki şema kimerik antijen reseptör T-hücre tedavisi (KAR) sürecini temsil etmektedir, bu kanser tedavisinde giderek artan bir uygulama olan bir immünoterapi yöntemidir. Nihai sonuç, vücuttaki enfekte kanser hücrelerini tanıyabilen ve bunlarla savaşabilen donanımlı T-hücrelerinin üretilmesi olmalıdır.
| |
| MeSH | D007167 |
| OPS-301 kodu | 8-03 |
İmmünoterapi veya biyolojik terapi, bağışıklık sistemini aktive ederek veya baskılayarak hastalığın tedavi edilmesidir. Bir immün yanıtı ortaya çıkarmak veya güçlendirmek için tasarlanan immünoterapiler aktivasyon immünoterapileri olarak sınıflandırılırken, azaltan veya baskılayan immünoterapiler baskılama immünoterapileri olarak sınıflandırılır. İmmünoterapi, çeşitli kanser türlerini tedavi etme potansiyeli açısından ön araştırma aşamasındadır.[1][2][3][4]
Hücre bazlı immünoterapiler bazı kanserler için etkilidir.[5][6] Lenfositler, makrofajlar, dendritik hücreler, doğal öldürücü hücreler ve sitotoksik T lenfositler gibi immün efektör hücreler, tümör hücrelerinin yüzeyinde ifade edilen anormal antijenleri hedef alarak vücudu kansere karşı savunmak için birlikte çalışır. COVID-19'a karşı aşı kaynaklı bağışıklık, çoğunlukla immünomodülatör bir T hücresi yanıtına dayanır.[7]
Granülosit koloni uyarıcı faktör (G-CSF), interferonlar, imikuimod ve bakterilerden elde edilen hücresel membran fraksiyonları gibi tedaviler tıbbi kullanım için lisanslıdır. IL-2, IL-7, IL-12, çeşitli kemokinler, sentetik sitozin fosfat-guanozin (CpG) oligodeoksinükleotidler ve glukanlar gibi diğerleri klinik ve klinik öncesi çalışmalarda yer almaktadır.
İmmünomodülatörler
İmmünomodülatörler immünoterapinin aktif ajanlarıdır. Bunlar rekombinant, sentetik ve doğal preparatlardan oluşan çeşitli bir dizidir.[8]
| Sınıf | Örnek ajanlar |
|---|---|
| İnterlökinler | IL-2, IL-7, IL-12 |
| Sitokinler | İnterferonlar, G-CSF |
| Kemokinler | CCL3, CCL26, CXCL7 |
| İmmünomodülatör imid ilaçlar (IMiD'ler) | Talidomid ve analogları (lenalidomid, pomalidomid ve apremilast), BCG aşısı,[9][10] ve Covid aşıları[11][7][12] |
| Diğer | sitozin fosfat-guanozin, oligodeoksinükleotitler, glukanlar |
Aktivasyon immünoterapileri
Kanser
Kanser tedavisi eskiden kemoterapi, ameliyat veya radyasyonla kanser hücrelerini ve tümörleri öldürmeye veya ortadan kaldırmaya odaklanırdı. Bu tedaviler çok etkili olabilir ve birçok durumda hala kullanılmaktadır. 2018 yılında Nobel Fizyoloji veya Tıp Ödülü, "negatif bağışıklık düzenlemesinin engellenmesi yoluyla kanser tedavisini keşfettikleri için" James P. Allison ve Tasuku Honjo'ya verildi. Kanser immünoterapisi, tümörleri yok etmek için bağışıklık sistemini uyarmaya çalışır. Çeşitli stratejiler kullanılmakta ya da araştırma ve test aşamasındadır. Farklı kanser türlerinde yapılan randomize kontrollü çalışmalarda sağkalımda ve hastalıksız dönemde önemli artışlar bildirilmiştir[2] ve hücre bazlı immünoterapi geleneksel tedavi yöntemleriyle birleştirildiğinde etkinliği %20-30 oranında artmaktadır.[2]
Kanser immünoterapisinin en eski formlarından biri, başlangıçta tüberküloza karşı aşılamak için kullanılan ve daha sonra mesane kanseri tedavisinde yararlı olduğu bulunan BCG aşısının kullanılmasıdır.[13] BCG immünoterapisi hem lokal hem de sistemik immün yanıtları indükler. BCG immünoterapisinin tümör bağışıklığına aracılık ettiği mekanizmalar geniş çapta incelenmiştir, ancak bunlar hala tam olarak anlaşılamamıştır.[14]
Kanser tedavisinde monoklonal antikorların kullanımı ilk olarak 1997 yılında B hücreli lenfoma tedavisinde kullanılan bir anti-CD20 antikoru olan rituximab ile başlamıştır.[15] O zamandan beri çeşitli hematolojik malignitelerin yanı sıra solid tümörlerin tedavisi için de birçok monoklonal antikor onaylanmıştır.[16][17]
G-CSF lenfositlerinin kandan ekstraksiyonu ve hücrelerin uygun uyarıcı sitokinlerle yeniden enjekte edilmesinden önce bir tümör antijenine karşı in vitro olarak genişletilir. Hücreler daha sonra antijeni ifade eden tümör hücrelerini yok eder.[18] Topikal immünoterapi, interferon üreten ve alıcının öldürücü T hücrelerinin siğilleri,[19] aktinik keratozları, bazal hücre kanserini, vajinal intraepitelyal neoplaziyi,[20] skuamöz hücre kanserini,[21][22] kutanöz lenfomayı[23] ve yüzeysel malign melanomu[24] yok etmesini sağlayan bir immün güçlendirme kremi (imiquimod) kullanır. Enjeksiyon immünoterapisi ("intralezyonel" veya "intratümöral") siğilleri (HPV kaynaklı tümörler) tedavi etmek için kabakulak, kandida, HPV aşısı[25][26] veya trikofitin antijen enjeksiyonlarını kullanır.
Adoptif hücre transferi akciğer[27] ve diğer kanserler üzerinde test edilmiş olup en büyük başarı melanomda elde edilmiştir.
Dendritik hücre bazlı pompa hazırlama veya aşılama
Dendritik hücreler (DH) bir antijene karşı sitotoksik bir yanıtı aktive etmek için uyarılabilir. Bir tür antijen sunan hücre olan dendritik hücreler, immünoterapiye ihtiyaç duyan kişiden toplanır. Bu hücreler daha sonra ya bir antijen ya da tümör lizatı ile pulslanır ya da bir viral vektör ile transfekte edilerek antijeni göstermeleri sağlanır. Kişiye transfüzyon yapıldıktan sonra bu aktive hücreler antijeni efektör lenfositlere (CD4+ yardımcı T hücreleri, sitotoksik CD8+ T hücreleri ve B hücreleri) sunar. Bu, antijeni ifade eden tümör hücrelerine karşı sitotoksik bir yanıt başlatır (adaptif yanıt artık buna karşı hazırlanmıştır). FDA onaylı ilk hücre bazlı immünoterapi olan[28] kanser aşısı Sipuleucel-T bu yaklaşımın bir örneğidir.[29] Immune Response Corporation[30] (IRC) bu immünoterapiyi geliştirmiş ve teknolojiyi FDA onayı alan Dendreon'a lisanslamıştır.
DH tabanlı aşılama için mevcut yaklaşımlar temel olarak monositlerden veya CD34+ hücrelerinden in vitro üretilen DH'lere antijen yüklenmesine, bunların farklı TLR ligandları, sitokin kombinasyonları ile aktive edilmesine ve hastalara geri enjekte edilmesine dayanmaktadır. In vivo hedefleme yaklaşımları spesifik sitokinlerin (örn. Flt3L, GM-CSF) uygulanmasını ve DH'lerin C-tipi lektin reseptörlerine karşı antikorlarla veya ilgilenilen antijenle konjuge edilmiş agonistik antikorlarla (örn. anti-CD40) hedeflenmesini içermektedir. Gelecekteki yaklaşım, spesifik olarak ifade edilen C-tipi lektin reseptörlerine veya kemokin reseptörlerine dayalı DH alt kümelerini hedefleyebilir. Bir diğer potansiyel yaklaşım ise indüklenmiş pluripotent kök hücrelerden genetik olarak tasarlanmış DH'lerin üretilmesi ve daha iyi klinik sonuçlar elde etmek için neoantijen yüklü DH'lerin kullanılmasıdır.[31]
T hücresi adaptif transferi
In vitro adoptif hücre transferi, daha sonra transfüzyon için otolog, ekstrakte edilmiş T hücrelerini geliştirir.[32]
Alternatif olarak, genetiği değiştirilmiş T hücreleri, T hücrelerinin toplanması ve ardından T hücrelerine tümör antijenlerini tanımak için özelleşmiş bir T hücresi reseptörü (TCR) geninin bir kopyasını içeren bir retrovirüsün bulaştırılmasıyla oluşturulur. Virüs, reseptörü T hücrelerinin genomuna entegre eder. Hücreler spesifik olmayan bir şekilde genişletilir ve/veya uyarılır.[33] Hücreler daha sonra yeniden aşılanır ve tümör hücrelerine karşı bir bağışıklık yanıtı üretir. Bu teknik, refrakter evre IV metastatik melanomlar[32] ve ilerlemiş cilt kanseri üzerinde test edilmiştir.[34][35][36] FDA onaylı ilk CAR-T ilacı olan Kymriah bu yaklaşımı kullanmıştır. Novartis, bu CAR-T'nin klinik ve ticari tedarikini elde etmek için üretim tesisini, dağıtım sistemini satın aldı ve Dendreon ve Immune Response Corporation tarafından geliştirilen Sipuleucel-T'yi üreten üretim ekibini işe aldı.[37]
T hücreleri genetik olarak tasarlanmış olsun ya da olmasın, yeniden infüzyondan önce, düzenleyici T hücrelerinin yanı sıra homeostatik sitokinler için transfer edilen hücrelerle rekabet eden değiştirilmemiş, endojen lenfositleri ortadan kaldırmak için alıcının lenfo-deplasmanı gereklidir.[32][38][39][40] Lenfodepletion myeloablatif kemoterapi ile sağlanabilir ve buna daha etkili olması için tüm vücut ışınlaması eklenebilir.[41] Aktarılan hücreler in vivo çoğalmış ve birçok kişide periferik kanda kalıcı olmuş, bazen infüzyondan 6-12 ay sonra tüm CD8+ T hücrelerinin %75'ini temsil etmiştir.[42] 2012 itibarıyla, metastatik melanom için klinik çalışmalar birçok bölgede devam etmektedir.[43] Çoklu immünoterapilere dirençli metastatik melanomlu hastalarda T hücrelerinin evlat edinme yoluyla transferine klinik yanıtlar gözlenmiştir.[44]
Kontrol noktası inhibitörleri
Anti-PD-1/PD-L1 ve anti-CTLA-4 antikorları şu anda hastalar için mevcut olan iki tip kontrol noktası inhibitörüdür. Anti-sitotoksik T-lenfosit-ilişkili protein 4 (CTLA-4) ve anti-programlanmış hücre ölüm proteini 1 (PD-1) antikorlarının insan kullanımı için onaylanması, çeşitli kanserler için hastalık sonuçlarında önemli iyileşmelerle sonuçlanmıştır.[45]
Bu moleküller başlangıçta T hücresi aktivasyonu veya apoptozda rol oynayan moleküller olarak keşfedilmiş olsa da, daha sonraki preklinik araştırmalar periferik immün toleransın sürdürülmesindeki önemli rollerini göstermiştir.[46]
Bağışıklık kontrol noktası inhibitörleri, melanom, meme kanseri, mesane kanseri, rahim ağzı kanseri, kolon kanseri, baş ve boyun kanseri veya Hodgkin lenfoma dahil olmak üzere çeşitli kanser türlerine sahip bazı hastaları tedavi etmek için onaylanmıştır.[47]
Bu tedaviler, en immünojenik insan kanserlerinden biri olarak kabul edilen metastatik melanomda uzun yıllar süren araştırmalarda ilk kez genel sağkalımda bir iyileşme göstererek kanser immünoterapisinde devrim yaratmış ve giderek artan bir hasta grubu bu tedavilerden uzun vadeli olarak faydalanmıştır.[46]
Bağışıklık güçlendirme tedavisi
Otolog bağışıklık güçlendirme tedavisinde kişinin kendi periferik kanından elde edilen doğal öldürücü hücreler, sitotoksik T lenfositleri, epitel hücreleri ve diğer ilgili bağışıklık hücreleri in vitro olarak genişletilir ve daha sonra yeniden infüze edilir.[48] Bu terapi hepatit C,[49][50][51] kronik yorgunluk sendromu[52][53] ve HHV6[54] enfeksiyonuna karşı test edilmiştir.
Baskılama immünoterapileri
Bağışıklık bastırma, otoimmün hastalıklarda anormal bir bağışıklık tepkisini azaltır veya nakledilen organların veya hücrelerin reddedilmesini önlemek için normal bir bağışıklık tepkisini azaltır.
İmmünsüpresif ilaçlar
İmmünsüpresif ilaçlar organ nakli ve otoimmün hastalıkların yönetimine yardımcı olur. Bağışıklık tepkileri lenfosit proliferasyonuna bağlıdır. Sitostatik ilaçlar immünosupresiftir. Glukokortikoidler lenfosit aktivasyonunun biraz daha spesifik inhibitörleridir, immünofilin inhibitörleri ise daha spesifik olarak T lenfosit aktivasyonunu hedefler. İmmünsüpresif antikorlar bağışıklık yanıtındaki basamakları hedef alır. Diğer ilaçlar immün yanıtları modüle eder ve immün regülasyonu indüklemek için kullanılabilir. Preklinik bir çalışmada, düşük doz rejimi altında ve deri altından uygulanan D vitamini, deksametazon ve kurkumin gibi küçük immünosupresif moleküllerle bağışıklık sisteminin düzenlenmesinin kronik enflamasyonun önlenmesinde veya tedavisinde yardımcı olabileceği gözlenmiştir.[55][56]
Bağışıklık toleransı
Vücut doğal olarak kendi dokularına karşı bir bağışıklık sistemi saldırısı başlatmaz. Modeller genellikle CD4+ T hücrelerini otoimmün yanıtın merkezinde tanımlar. T-hücresi toleransının kaybı, B-hücrelerini ve diğer bağışıklık efektör hücrelerini hedef dokuya doğru serbest bırakır. İdeal tolerojenik tedavi, otoimmün saldırıyı koordine eden spesifik T-hücresi klonlarını hedef alacaktır.[57]
İmmün tolerans tedavileri bağışıklık sistemini sıfırlamaya çalışır, böylece vücut otoimmün hastalıkta yanlışlıkla kendi organlarına veya hücrelerine saldırmayı durdurur veya organ naklinde yabancı dokuyu kabul eder.[58] Yeni[] bir terapötik yaklaşım, düzenleyici bağışıklık hücrelerinin nakil alıcılarına infüzyonudur. Düzenleyici bağışıklık hücrelerinin transferi, efektör aktivitesini engelleme potansiyeline sahiptir.[59][60]
Bağışıklık toleransı oluşturmak, ömür boyu bağışıklık baskısı ihtiyacını ve buna bağlı yan etkileri azaltır veya ortadan kaldırır. Transplantasyonlar, romatoid artrit, tip 1 diyabet ve diğer otoimmün bozukluklar üzerinde test edilmiştir.
| modalite | Detaylar | ||
|---|---|---|---|
| Antijene spesifik olmayan | Monoklonal antikorlar | Tükenen:
| Tükenmeyen:
|
| Hematopoietik kök hücre nakli | Miyeloablatif olmayan | Miyeloablatif | |
| Mezenkimal kök hücre nakli | |||
| Düzenleyici T hücresi tedavisi | Antijene özgü olmayan | Antijene özgü | |
| Düzenleyici T hücrelerini genişletmek için düşük doz IL-2 | |||
| Mikrobiyom manipülasyonu | |||
| Antijene özgü | Peptit tedavisi | Deri altı, intradermal, transmukozal (oral, inhale) Tolerojenik dendritik hücreler, lipozomlar ve nanopartiküller | |
| Değiştirilmiş peptid ligandları | |||
Alerjiler
İmmünoterapi alerjileri tedavi etmek için de kullanılabilir. Alerji tedavileri (antihistaminikler veya kortikosteroidler gibi) alerjik semptomları tedavi ederken, immünoterapi alerjenlere karşı hassasiyeti azaltarak alerjinin şiddetini azaltabilir.
İmmünoterapi uzun vadeli faydalar sağlayabilir.[63] İmmünoterapi bazı kişilerde kısmen etkili, bazılarında ise etkisizdir, ancak alerjisi olan kişilere semptomlarını azaltma veya durdurma şansı sunar.[]
Terapi, aşırı alerjisi olan veya belirli alerjenlerden kaçınamayan kişiler için endikedir.
Gıda alerjilerini tedavi etmek için umut verici bir yaklaşım oral immünoterapinin (OIT) kullanılmasıdır. OIT, artan miktarlarda alerjene kademeli olarak maruz kalmayı içerir ve deneklerin çoğunun kazara maruz kalındığında reaksiyonu önlemeye yetecek gıda dozlarını tolere etmesine yol açabilir.[64] Kişi duyarsızlaştıkça dozajlar zaman içinde artar. Bu teknik, yer fıstığı alerjilerini önlemek için bebekler üzerinde test edilmiştir.[65]
Helmintik tedaviler
Kamçılı kurt yumurtası (Trichuris suis) ve kancalı kurt (Necator americanus) immünolojik hastalıklar ve alerjiler için test edilmiştir. Helmintik tedavi, nükseden tekrarlayıcı multipl skleroz,[66] Crohn,[67][68][69] alerji ve astım için bir tedavi olarak araştırılmıştır.[70] Helmintlerin bağışıklık yanıtını nasıl modüle ettiğinin mekanizması bilinmemektedir. Varsayılan mekanizmalar arasında Th1 / Th2 yanıtının yeniden polarizasyonu[71] ve dendritik hücre fonksiyonunun modülasyonu yer almaktadır.[72][73] Helmintler pro-enflamatuar Th1 sitokinleri, interlökin-12 (IL-12), interferon gama (IFN-γ) ve tümör nekroz faktörü-alfayı (TNF-α) aşağı regüle ederken, IL-10, IL-4, IL-5 ve IL-13 gibi düzenleyici Th2 sitokinlerinin üretimini teşvik eder.[71][74]
Helmintlerle birlikte evrimleşme, Crohn, ülseratif kolit ve çölyak hastalığı gibi interlökin ekspresyonu ve immünolojik bozukluklarla ilişkili bazı genleri şekillendirmiştir. Helmintlerin konakçı olarak insanlarla ilişkisi mutualistik veya simbiyotik olarak sınıflandırılmalıdır.[75]
Ayrıca bakınız
Kaynakça
- ^ "Immunotherapy | Memorial Sloan Kettering Cancer Center". mskcc.org. 19 Ekim 2019 tarihinde kaynağından arşivlendi. Erişim tarihi: 27 Temmuz 2017.
- ^ a b c Syn NL, Teng MW, Mok TS, Soo RA (December 2017). "De-novo and acquired resistance to immune checkpoint targeting". The Lancet. Oncology. 18 (12): e731-e741. doi:10.1016/s1470-2045(17)30607-1. PMID 29208439.
- ^ Conforti L (February 2012). "The ion channel network in T lymphocytes, a target for immunotherapy". Clinical Immunology. 142 (2): 105-106. doi:10.1016/j.clim.2011.11.009. PMID 22189042.
- ^ Wang, Shuhang; Zimmermann, Stefan; Parikh, Kaushal; Mansfield, Aaron S.; Adjei, Alex A. (Ağustos 2019). "Current Diagnosis and Management of Small-Cell Lung Cancer". Mayo Clinic Proceedings. 94 (8): 1599-1622. doi:10.1016/j.mayocp.2019.01.034. ISSN 0025-6196. 2 Kasım 2023 tarihinde kaynağından arşivlendi. Erişim tarihi: 23 Ekim 2023.
- ^ Riley RS, June CH, Langer R, Mitchell MJ (March 2019). "Delivery technologies for cancer immunotherapy". Nature Reviews. Drug Discovery. 18 (3): 175-196. doi:10.1038/s41573-018-0006-z. PMC 6410566 $2. PMID 30622344.
- ^ Li Y, McBride DW, Tang Y, Doycheva D, Zhang JH, Tang Z (September 2023). "Immunotherapy as a treatment for Stroke: Utilizing regulatory T cells". Brain Hemorrhages. 4 (3): 147-153. doi:10.1016/j.hest.2023.02.003. ISSN 2589-238X.
- ^ a b Geers D, Shamier MC, Bogers S, den Hartog G, Gommers L, Nieuwkoop NN, Schmitz KS, Rijsbergen LC, van Osch JA, Dijkhuizen E, Smits G, Comvalius A, van Mourik D, Caniels TG, van Gils MJ, Sanders RW, Oude Munnink BB, Molenkamp R, de Jager HJ, Haagmans BL, de Swart RL, Koopmans MP, van Binnendijk RS, de Vries RD, GeurtsvanKessel CH (May 2021). "SARS-CoV-2 variants of concern partially escape humoral but not T-cell responses in COVID-19 convalescent donors and vaccinees". Science Immunology. 6 (59): eabj1750. doi:10.1126/sciimmunol.abj1750. PMC 9268159 $2. PMID 34035118.
- ^ Rizk JG, Kalantar-Zadeh K, Mehra MR, Lavie CJ, Rizk Y, Forthal DN (September 2020). "Pharmaco-Immunomodulatory Therapy in COVID-19". Drugs. 80 (13): 1267-1292. doi:10.1007/s40265-020-01367-z. PMC 7372203 $2. PMID 32696108.
- ^ "Immunomodulators and Their Side Effects". www.cancer.org. 8 Nisan 2023 tarihinde kaynağından arşivlendi. Erişim tarihi: 6 Haziran 2021.
- ^ Martino A, Casetti R, Poccia F (January 2007). "Enhancement of BCG-induced Th1 immune response through Vgamma9Vdelta2 T cell activation with non-peptidic drugs". Vaccine. 25 (6): 1023-1029. doi:10.1016/j.vaccine.2006.09.070. PMID 17118497.
- ^ Sahin U, Muik A, Derhovanessian E, Vogler I, Kranz LM, Vormehr M, Baum A, Pascal K, Quandt J, Maurus D, Brachtendorf S, Lörks V, Sikorski J, Hilker R, Becker D, Eller AK, Grützner J, Boesler C, Rosenbaum C, Kühnle MC, Luxemburger U, Kemmer-Brück A, Langer D, Bexon M, Bolte S, Karikó K, Palanche T, Fischer B, Schultz A, Shi PY, Fontes-Garfias C, Perez JL, Swanson KA, Loschko J, Scully IL, Cutler M, Kalina W, Kyratsous CA, Cooper D, Dormitzer PR, Jansen KU, Türeci Ö (October 2020). "COVID-19 vaccine BNT162b1 elicits human antibody and TH1 T cell responses". Nature. 586 (7830): 594-599. Bibcode:2020Natur.586..594S. doi:10.1038/s41586-020-2814-7. PMID 32998157.
- ^ Woldemeskel BA, Garliss CC, Blankson JN (May 2021). "SARS-CoV-2 mRNA vaccines induce broad CD4+ T cell responses that recognize SARS-CoV-2 variants and HCoV-NL63". The Journal of Clinical Investigation. 131 (10). doi:10.1172/JCI149335. PMC 8121504 $2. PMID 33822770.
- ^ Fuge O, Vasdev N, Allchorne P, Green JS (2015). "Immunotherapy for bladder cancer". Research and Reports in Urology. 7: 65-79. doi:10.2147/RRU.S63447. PMC 4427258 $2. PMID 26000263.
- ^ Pettenati C, Ingersoll MA (October 2018). "Mechanisms of BCG immunotherapy and its outlook for bladder cancer". Nature Reviews. Urology. 15 (10): 615-625. doi:10.1038/s41585-018-0055-4. PMID 29991725.
- ^ Salles G, Barrett M, Foà R, Maurer J, O'Brien S, Valente N, Wenger M, Maloney DG (October 2017). "Rituximab in B-Cell Hematologic Malignancies: A Review of 20 Years of Clinical Experience". Advances in Therapy. 34 (10): 2232-2273. doi:10.1007/s12325-017-0612-x. PMC 5656728 $2. PMID 28983798.
- ^ Hoos A (April 2016). "Development of immuno-oncology drugs - from CTLA4 to PD1 to the next generations". Nature Reviews. Drug Discovery. 15 (4): 235-247. doi:10.1038/nrd.2015.35. PMID 26965203.
- ^ Pento JT (November 2017). "Monoclonal Antibodies for the Treatment of Cancer". Anticancer Research. 37 (11): 5935-5939. doi:10.21873/anticanres.12040. PMC 3288558 $2. PMID 29061772.
- ^ Simpson RJ, Bigley AB, Agha N, Hanley PJ, Bollard CM (July 2017). "Mobilizing Immune Cells With Exercise for Cancer Immunotherapy". Exercise and Sport Sciences Reviews. 45 (3): 163-172. doi:10.1249/JES.0000000000000114. PMC 6814300 $2. PMID 28418996.
- ^ van Seters M, van Beurden M, ten Kate FJ, Beckmann I, Ewing PC, Eijkemans MJ, Kagie MJ, Meijer CJ, Aaronson NK, Kleinjan A, Heijmans-Antonissen C, Zijlstra FJ, Burger MP, Helmerhorst TJ (April 2008). "Treatment of vulvar intraepithelial neoplasia with topical imiquimod". The New England Journal of Medicine. 358 (14): 1465-1473. doi:10.1056/NEJMoa072685. PMID 18385498.
- ^ Buck HW, Guth KJ (October 2003). "Treatment of vaginal intraepithelial neoplasia (primarily low grade) with imiquimod 5% cream". Journal of Lower Genital Tract Disease. 7 (4): 290-293. doi:10.1097/00128360-200310000-00011. PMID 17051086.
- ^ Järvinen R, Kaasinen E, Sankila A, Rintala E (August 2009). "Long-term efficacy of maintenance bacillus Calmette-Guérin versus maintenance mitomycin C instillation therapy in frequently recurrent TaT1 tumours without carcinoma in situ: a subgroup analysis of the prospective, randomised FinnBladder I study with a 20-year follow-up". European Urology. 56 (2): 260-265. doi:10.1016/j.eururo.2009.04.009. PMID 19395154.
- ^ Davidson HC, Leibowitz MS, Lopez-Albaitero A, Ferris RL (September 2009). "Immunotherapy for head and neck cancer". Oral Oncology. 45 (9): 747-751. doi:10.1016/j.oraloncology.2009.02.009. PMC 8978306 $2. PMID 19442565.
- ^ Dani T, Knobler R (January 2009). "Extracorporeal photoimmunotherapy-photopheresis". Frontiers in Bioscience. 14 (14): 4769-4777. doi:10.2741/3566. PMID 19273388.
- ^ Eggermont AM, Schadendorf D (June 2009). "Melanoma and immunotherapy". Hematology/Oncology Clinics of North America. 23 (3): 547-64, ix-x. doi:10.1016/j.hoc.2009.03.009. PMID 19464602.
- ^ Chuang CM, Monie A, Wu A, Hung CF (May 2009). "Combination of apigenin treatment with therapeutic HPV DNA vaccination generates enhanced therapeutic antitumor effects". Journal of Biomedical Science. 16 (1): 49. doi:10.1186/1423-0127-16-49. PMC 2705346 $2. PMID 19473507.
- ^ Pawlita M, Gissmann L (April 2009). "[Recurrent respiratory papillomatosis: indication for HPV vaccination?]". Deutsche Medizinische Wochenschrift (Almanca). 134 (Suppl 2): S100-S102. doi:10.1055/s-0029-1220219. PMID 19353471.
- ^ Kang N, Zhou J, Zhang T, Wang L, Lu F, Cui Y, Cui L, He W (August 2009). "Adoptive immunotherapy of lung cancer with immobilized anti-TCRgammadelta antibody-expanded human gammadelta T-cells in peripheral blood". Cancer Biology & Therapy. 8 (16): 1540-1549. doi:10.4161/cbt.8.16.8950. PMID 19471115.
- ^ Cheever MA, Higano CS (June 2011). "PROVENGE (Sipuleucel-T) in prostate cancer: the first FDA-approved therapeutic cancer vaccine". Clinical Cancer Research. 17 (11): 3520-3526. doi:10.1158/1078-0432.CCR-10-3126. PMID 21471425.
- ^ Di Lorenzo G, Buonerba C, Kantoff PW (May 2011). "Immunotherapy for the treatment of prostate cancer". Nature Reviews. Clinical Oncology. 8 (9): 551-561. doi:10.1038/nrclinonc.2011.72. PMID 21606971.
- ^ "Sipuleucel-T: APC 8015, APC-8015, prostate cancer vaccine--Dendreon". Drugs in R&D. 7 (3): 197-201. 2006. doi:10.2165/00126839-200607030-00006. PMID 16752945.
- ^ Sabado RL, Balan S, Bhardwaj N (January 2017). "Dendritic cell-based immunotherapy". Cell Research. 27 (1): 74-95. doi:10.1038/cr.2016.157. PMC 5223236 $2. PMID 28025976.
- ^ a b c Rosenberg SA, Restifo NP, Yang JC, Morgan RA, Dudley ME (April 2008). "Adoptive cell transfer: a clinical path to effective cancer immunotherapy". Nature Reviews. Cancer. 8 (4): 299-308. doi:10.1038/nrc2355. PMC 2553205 $2. PMID 18354418.
- ^ Morgan RA, Dudley ME, Wunderlich JR, Hughes MS, Yang JC, Sherry RM, Royal RE, Topalian SL, Kammula US, Restifo NP, Zheng Z, Nahvi A, de Vries CR, Rogers-Freezer LJ, Mavroukakis SA, Rosenberg SA (October 2006). "Cancer regression in patients after transfer of genetically engineered lymphocytes". Science. 314 (5796): 126-129. Bibcode:2006Sci...314..126M. doi:10.1126/science.1129003. PMC 2267026 $2. PMID 16946036.
- ^ Hunder NN, Wallen H, Cao J, Hendricks DW, Reilly JZ, Rodmyre R, Jungbluth A, Gnjatic S, Thompson JA, Yee C (June 2008). "Treatment of metastatic melanoma with autologous CD4+ T cells against NY-ESO-1". The New England Journal of Medicine. 358 (25): 2698-2703. doi:10.1056/NEJMoa0800251. PMC 3277288 $2. PMID 18565862.
- ^ "2008 Symposium Program & Speakers". Cancer Research Institute. 15 Ekim 2008 tarihinde kaynağından arşivlendi.
- ^ Highfield R (18 Haziran 2008). "Cancer patient recovers after injection of immune cells". The Telegraph. 12 Eylül 2008 tarihinde kaynağından arşivlendi. Erişim tarihi: 22 Aralık 2019.
- ^ "UPDATED: Novartis buys Dendreon New Jersey plant". Fierce Pharma (İngilizce). 20 Aralık 2012. 7 Haziran 2023 tarihinde kaynağından arşivlendi. Erişim tarihi: 9 Aralık 2021.
- ^ Antony PA, Piccirillo CA, Akpinarli A, Finkelstein SE, Speiss PJ, Surman DR, Palmer DC, Chan CC, Klebanoff CA, Overwijk WW, Rosenberg SA, Restifo NP (March 2005). "CD8+ T cell immunity against a tumor/self-antigen is augmented by CD4+ T helper cells and hindered by naturally occurring T regulatory cells". Journal of Immunology. 174 (5): 2591-2601. doi:10.4049/jimmunol.174.5.2591. PMC 1403291 $2. PMID 15728465.
- ^ Gattinoni L, Finkelstein SE, Klebanoff CA, Antony PA, Palmer DC, Spiess PJ, Hwang LN, Yu Z, Wrzesinski C, Heimann DM, Surh CD, Rosenberg SA, Restifo NP (October 2005). "Removal of homeostatic cytokine sinks by lymphodepletion enhances the efficacy of adoptively transferred tumor-specific CD8+ T cells". The Journal of Experimental Medicine. 202 (7): 907-912. doi:10.1084/jem.20050732. PMC 1397916 $2. PMID 16203864.
- ^ Dummer W, Niethammer AG, Baccala R, Lawson BR, Wagner N, Reisfeld RA, Theofilopoulos AN (July 2002). "T cell homeostatic proliferation elicits effective antitumor autoimmunity". The Journal of Clinical Investigation. 110 (2): 185-192. doi:10.1172/JCI15175. PMC 151053 $2. PMID 12122110.
- ^ Dudley ME, Yang JC, Sherry R, Hughes MS, Royal R, Kammula U, Robbins PF, Huang J, Citrin DE, Leitman SF, Wunderlich J, Restifo NP, Thomasian A, Downey SG, Smith FO, Klapper J, Morton K, Laurencot C, White DE, Rosenberg SA (November 2008). "Adoptive cell therapy for patients with metastatic melanoma: evaluation of intensive myeloablative chemoradiation preparative regimens". Journal of Clinical Oncology. 26 (32): 5233-5239. doi:10.1200/JCO.2008.16.5449. PMC 2652090 $2. PMID 18809613.
- ^ Dudley ME, Wunderlich JR, Robbins PF, Yang JC, Hwu P, Schwartzentruber DJ, Topalian SL, Sherry R, Restifo NP, Hubicki AM, Robinson MR, Raffeld M, Duray P, Seipp CA, Rogers-Freezer L, Morton KE, Mavroukakis SA, White DE, Rosenberg SA (October 2002). "Cancer regression and autoimmunity in patients after clonal repopulation with antitumor lymphocytes". Science. 298 (5594): 850-854. Bibcode:2002Sci...298..850D. doi:10.1126/science.1076514. PMC 1764179 $2. PMID 12242449.
- ^ Pilon-Thomas S, Kuhn L, Ellwanger S, Janssen W, Royster E, Marzban S, Kudchadkar R, Zager J, Gibney G, Sondak VK, Weber J, Mulé JJ, Sarnaik AA (October 2012). "Efficacy of adoptive cell transfer of tumor-infiltrating lymphocytes after lymphopenia induction for metastatic melanoma". Journal of Immunotherapy. 35 (8): 615-620. doi:10.1097/CJI.0b013e31826e8f5f. PMC 4467830 $2. PMID 22996367.
- ^ Andersen R, Borch TH, Draghi A, Gokuldass A, Rana MA, Pedersen M, Nielsen M, Kongsted P, Kjeldsen JW, Westergaard MC, Radic HD, Chamberlain CA, Hölmich LR, Hendel HW, Larsen MS, Met Ö, Svane IM, Donia M (July 2018). "T cells isolated from patients with checkpoint inhibitor-resistant melanoma are functional and can mediate tumor regression". Annals of Oncology. 29 (7): 1575-1581. doi:10.1093/annonc/mdy139. PMID 29688262.
- ^ Seidel JA, Otsuka A, Kabashima K (28 Mart 2018). "Anti-PD-1 and Anti-CTLA-4 Therapies in Cancer: Mechanisms of Action, Efficacy, and Limitations". Frontiers in Oncology. 8: 86. doi:10.3389/fonc.2018.00086. PMC 5883082 $2. PMID 29644214.
- ^ a b Haanen JB, Robert C (2015). "Immune Checkpoint Inhibitors". Progress in Tumor Research. 42: 55-66. doi:10.1159/000437178. ISBN 978-3-318-05589-4. PMID 26382943.
- ^ "Immune Checkpoint Inhibitors - National Cancer Institute". National Cancer Institute. 24 Eylül 2019. 22 Ekim 2023 tarihinde kaynağından arşivlendi. Erişim tarihi: 24 Ağustos 2020.
- ^ Manjunath SR, Ramanan G, Dedeepiya VD, Terunuma H, Deng X, Baskar S, Senthilkumar R, Thamaraikannan P, Srinivasan T, Preethy S, Abraham SJ (January 2012). "Autologous immune enhancement therapy in recurrent ovarian cancer with metastases: a case report". Case Reports in Oncology. 5 (1): 114-118. doi:10.1159/000337319. PMC 3364094 $2. PMID 22666198.
- ^ Li Y, Zhang T, Ho C, Orange JS, Douglas SD, Ho WZ (December 2004). "Natural killer cells inhibit hepatitis C virus expression". Journal of Leukocyte Biology. 76 (6): 1171-1179. doi:10.1189/jlb.0604372. PMID 15339939.
- ^ Doskali M, Tanaka Y, Ohira M, Ishiyama K, Tashiro H, Chayama K, Ohdan H (March 2011). "Possibility of adoptive immunotherapy with peripheral blood-derived CD3−CD56+ and CD3+CD56+ cells for inducing antihepatocellular carcinoma and antihepatitis C virus activity". Journal of Immunotherapy. 34 (2): 129-138. doi:10.1097/CJI.0b013e3182048c4e. PMID 21304407.
- ^ Terunuma H, Deng X, Dewan Z, Fujimoto S, Yamamoto N (2008). "Potential role of NK cells in the induction of immune responses: implications for NK cell-based immunotherapy for cancers and viral infections". International Reviews of Immunology. 27 (3): 93-110. doi:10.1080/08830180801911743. PMID 18437601.
- ^ See DM, Tilles JG (1996). "alpha-Interferon treatment of patients with chronic fatigue syndrome". Immunological Investigations. 25 (1–2): 153-164. doi:10.3109/08820139609059298. PMID 8675231.
- ^ Ojo-Amaize EA, Conley EJ, Peter JB (January 1994). "Decreased natural killer cell activity is associated with severity of chronic fatigue immune dysfunction syndrome". Clinical Infectious Diseases. 18 (Suppl 1): S157-S159. doi:10.1093/clinids/18.Supplement_1.S157. PMID 8148445.
- ^ Kida K, Isozumi R, Ito M (December 2000). "Killing of human Herpes virus 6-infected cells by lymphocytes cultured with interleukin-2 or -12". Pediatrics International. 42 (6): 631-636. doi:10.1046/j.1442-200x.2000.01315.x. PMID 11192519.
- ^ Ospina-Quintero L, Jaramillo JC, Tabares-Guevara JH, Ramírez-Pineda JR (24 Nisan 2020). "Reformulating Small Molecules for Cardiovascular Disease Immune Intervention: Low-Dose Combined Vitamin D/Dexamethasone Promotes IL-10 Production and Atheroprotection in Dyslipidemic Mice". Frontiers in Immunology. 11: 743. doi:10.3389/fimmu.2020.00743. PMC 7197409 $2. PMID 32395119.
- ^ Tabares-Guevara JH, Jaramillo JC, Ospina-Quintero L, Piedrahíta-Ochoa CA, García-Valencia N, Bautista-Erazo DE, Caro-Gómez E, Covián C, Retamal-Díaz A, Duarte LF, González PA, Bueno SM, Riedel CA, Kalergis AM, Ramírez-Pineda JR (8 Temmuz 2021). "IL-10-Dependent Amelioration of Chronic Inflammatory Disease by Microdose Subcutaneous Delivery of a Prototypic Immunoregulatory Small Molecule". Frontiers in Immunology. 12: 708955. doi:10.3389/fimmu.2021.708955. PMC 8297659 $2. PMID 34305950.
- ^ a b Rayner F, Isaacs JD (December 2018). "Therapeutic tolerance in autoimmune disease". Seminars in Arthritis and Rheumatism. 48 (3): 558-562. doi:10.1016/j.semarthrit.2018.09.008. PMID 30348449.
- ^ Rotrosen D, Matthews JB, Bluestone JA (July 2002). "The immune tolerance network: a new paradigm for developing tolerance-inducing therapies". The Journal of Allergy and Clinical Immunology. 110 (1): 17-23. doi:10.1067/mai.2002.124258. PMID 12110811.
- ^ Stolp J, Zaitsu M, Wood KJ (2019). "Immune Tolerance and Rejection in Organ Transplantation". Immunological Tolerance. Methods in Molecular Biology. 1899. ss. 159-180. doi:10.1007/978-1-4939-8938-6_12. ISBN 978-1-4939-8936-2. PMID 30649772.
- ^ McMurchy AN, Bushell A, Levings MK, Wood KJ (August 2011). "Moving to tolerance: clinical application of T regulatory cells". Seminars in Immunology. Advances in Transplantation. 23 (4): 304-313. doi:10.1016/j.smim.2011.04.001. PMC 3836227 $2. PMID 21620722.
- ^ Baker KF, Isaacs JD (March 2014). "Prospects for therapeutic tolerance in humans". Current Opinion in Rheumatology. 26 (2): 219-227. doi:10.1097/BOR.0000000000000029. PMC 4640179 $2. PMID 24378931.
- ^ Cooles FA, Isaacs JD (August 2010). "Treating to re-establish tolerance in inflammatory arthritis - lessons from other diseases". Best Practice & Research. Clinical Rheumatology. Pharmacotherapy: Concepts of Pathogenesis and Emerging Treatments. 24 (4): 497-511. doi:10.1016/j.berh.2010.01.007. PMID 20732648.
- ^ Durham SR, Walker SM, Varga EM, Jacobson MR, O'Brien F, Noble W, Till SJ, Hamid QA, Nouri-Aria KT (August 1999). "Long-term clinical efficacy of grass-pollen immunotherapy". The New England Journal of Medicine. 341 (7): 468-475. doi:10.1056/NEJM199908123410702. PMID 10441602.
- ^ MacGinnitie AJ, Rachid R, Gragg H, Little SV, Lakin P, Cianferoni A, Heimall J, Makhija M, Robison R, Chinthrajah RS, Lee J, Lebovidge J, Dominguez T, Rooney C, Lewis MO, Koss J, Burke-Roberts E, Chin K, Logvinenko T, Pongracic JA, Umetsu DT, Spergel J, Nadeau KC, Schneider LC (March 2017). "Omalizumab facilitates rapid oral desensitization for peanut allergy". The Journal of Allergy and Clinical Immunology. 139 (3): 873-881.e8. doi:10.1016/j.jaci.2016.08.010. PMC 5369605 $2. PMID 27609658.
- ^ "Oral immunotherapy for peanut allergy in young children". National Institutes of Health (NIH) (İngilizce). 7 Şubat 2022. 12 Temmuz 2023 tarihinde kaynağından arşivlendi. Erişim tarihi: 6 Haziran 2022.
- ^ Correale J, Farez M (February 2007). "Association between parasite infection and immune responses in multiple sclerosis". Annals of Neurology. 61 (2): 97-108. doi:10.1002/ana.21067. PMID 17230481.
- ^ Croese J, O'neil J, Masson J, Cooke S, Melrose W, Pritchard D, Speare R (January 2006). "A proof of concept study establishing Necator americanus in Crohn's patients and reservoir donors". Gut. 55 (1): 136-137. doi:10.1136/gut.2005.079129. PMC 1856386 $2. PMID 16344586.
- ^ Reddy A, Fried B (January 2009). "An update on the use of helminths to treat Crohn's and other autoimmunune diseases". Parasitology Research. 104 (2): 217-221. doi:10.1007/s00436-008-1297-5. PMID 19050918.
- ^ Laclotte C, Oussalah A, Rey P, Bensenane M, Pluvinage N, Chevaux JB, Trouilloud I, Serre AA, Boucekkine T, Bigard MA, Peyrin-Biroulet L (December 2008). "[Helminths and inflammatory bowel diseases]". Gastroenterologie Clinique et Biologique (Fransızca). 32 (12): 1064-1074. doi:10.1016/j.gcb.2008.04.030. PMID 18619749.
- ^ Zaccone P, Fehervari Z, Phillips JM, Dunne DW, Cooke A (October 2006). "Parasitic worms and inflammatory diseases". Parasite Immunology. 28 (10): 515-523. doi:10.1111/j.1365-3024.2006.00879.x. PMC 1618732 $2. PMID 16965287.
- ^ a b Brooker S, Bethony J, Hotez PJ (2004). "Human hookworm infection in the 21st century". Advances in Parasitology. 58: 197-288. doi:10.1016/S0065-308X(04)58004-1. ISBN 9780120317585. PMC 2268732 $2. PMID 15603764.
- ^ Fujiwara RT, Cançado GG, Freitas PA, Santiago HC, Massara CL, Dos Santos Carvalho O, Corrêa-Oliveira R, Geiger SM, Bethony J (2009). "Necator americanus infection: a possible cause of altered dendritic cell differentiation and eosinophil profile in chronically infected individuals". PLOS Neglected Tropical Diseases. 3 (3): e399. doi:10.1371/journal.pntd.0000399. PMC 2654967 $2. PMID 19308259.
- ^ Carvalho L, Sun J, Kane C, Marshall F, Krawczyk C, Pearce EJ (January 2009). "Review series on helminths, immune modulation and the hygiene hypothesis: mechanisms underlying helminth modulation of dendritic cell function". Immunology. 126 (1): 28-34. doi:10.1111/j.1365-2567.2008.03008.x. PMC 2632707 $2. PMID 19120496.
- ^ Fumagalli M, Pozzoli U, Cagliani R, Comi GP, Riva S, Clerici M, Bresolin N, Sironi M (June 2009). "Parasites represent a major selective force for interleukin genes and shape the genetic predisposition to autoimmune conditions". The Journal of Experimental Medicine. 206 (6): 1395-1408. doi:10.1084/jem.20082779. PMC 2715056 $2. PMID 19468064.
- ^ Reynolds LA, Finlay BB, Maizels RM (November 2015). "Cohabitation in the Intestine: Interactions among Helminth Parasites, Bacterial Microbiota, and Host Immunity". Journal of Immunology. 195 (9): 4059-4066. doi:10.4049/jimmunol.1501432. PMC 4617609 $2. PMID 26477048.
Dış bağlantılar
- "Cancer Miracles". Forbes. 12 Şubat 2009. (İngilizce)
- Uluslararası Kanser Biyolojik Tedavi Derneği (İngilizce)
- Kanser Araştırma Enstitüsü Yıllık Uluslararası Kanser İmmünoterapi Sempozyumları Serisi (İngilizce)
- İmmünoterapinin yenilikçi hücresel yolculuğunun ardındaki hikaye (İngilizce)