Silikon veya polisiloksan, siloksanlardan (−R2Si−O−SiR2−, burada R = organik grup) oluşan bir polimerdir. Bunlar genellikle renksiz yağlar veya kauçuk benzeri maddelerdir. Silikonlar, dolgu macunlarında, yapıştırıcılarda, yağlayıcılarda, tıpta, pişirme kaplarında, ısı ve elektrik yalıtımında kullanılır. Bazı yaygın biçimler arasında silikon yağı, silikon gresi, silikon kauçuk, silikon reçine ve silikon kalafat bulunur.

Karbon, doğada yaygın bulunan ametal kimyasal elementtir. Evrende bolluk bakımından altıncı sırada yer alan karbon, kızgın yıldızlarda hidrojenin termonükleer yanmasında temel rol oynar. Dünyada hem doğal halde, hem de başka elementlerle bileşik halinde bulunan karbon, ağırlık olarak Dünya'nın yerkabuğunun yaklaşık %0,2'sini oluşturur. En arı (katışıksız) biçimleri elmas ve grafittir; daha düşük arılık derecelerinde maden kömürünün, kok kömürünün ve odun kömürünün bileşeni olarak bulunur. Atmosferin yaklaşık % 0,05'ini oluşturan ve bütün doğal sularda erimiş olarak bulunan karbon dioksit, kireç taşı ve mermer gibi karbonat mineralleri, kömürün, petrolün ve doğalgazın başlıca yapıtaşları olan hidrokarbonlar, en bol bulunan bileşikleridir.

Porfirin, dört metiliden (-CH=) köprüsüyle birbirine bağlı dört pirol halkasından ibaret olan porfin halka sistemi ihtiva eden molekül sistemidir. Bu molekül inorganik yapının organik yani canlı yaşamına nasıl evrildiğinin anlaşılmasını da sağlamıştır. Yani dünyadaki yaşam cansızdan canlıya bu madde ile geçmiştir. Doğada genellikle I ve III numaralı porfirin şekli bulunur. Porfirinlerdeki yan grupların dizilimi simetrik olduğu takdirde Tip I; asimetrik olduğu takdirde Tip III izomerleri oluşur. Tip III izomerleri en fazla bulunan ve önemli olan tiptir.

Karbonmonoksit, CO formülüne sahip sadece bir karbon ve bir oksijen atomundan oluşan inorganik bileşiktir Karbonmonoksitte karbon ve oksijen arasında üçlü bağ vardır. Endüstride jeneratör gazı, su gazı, kuvvet gazı ve hava gazı içinde kullanılır. Yakıt olarak da kullanılmaktadır.

Organik kimya, organik bileşiklerin ve organik maddelerin yani karbon atomlarını içeren çeşitli formlardaki maddelerin yapısını, özelliklerini ve reaksiyonların bilimsel çalışmasını içeren, kimyanın bir alt dalıdır. Yapının incelenmesi yapısal formüllerini belirler. Özelliklerin incelenmesi, fiziksel ve kimyasal özellikleri ve davranışlarını anlamak için kimyasal reaktivitenin değerlendirilmesidir. Organik reaksiyonların incelenmesi doğal ürünlerin, ilaçların ve polimerlerin kimyasal sentezini ve bireysel organik moleküllerin laboratuvarda ve teorik çalışma yoluyla incelenmesidir.

Kimya'da, hidrojen bağı öncelikle daha elektronegatif bir "verici" atom veya gruba (Dn) kovalent bağla bağlanan bir hidrojen (H) atomu ile ve yalnız bir çift elektron taşıyan başka bir elektronegatif atom arasındaki elektrostatik çekim kuvvetidir.

Aminler, amonyaktaki bir veya daha fazla hidrojen atomunun organik radikaller ile değiştirilmesi yöntemiyle türetilmiş organik bileşikler ve fonksiyonel gruplardır. Yapısal olarak aminler amonyağa benzerler, ama bir veya daha fazla hidrojen atomu, alkil veya aril gibi organik sübstitüentlerle yer değiştirmiştir. Bu kuralın önemli bir istisnası RC(O)NR2 tipi bileşiklerdir (C(O) karbonil grubuna karşılık gelir), bunlara amin yerine amid denir. Amidler ve aminlerin yapıları ve özellikleri farklı olduğu için bu ayrım kimyasal olarak önemlidir. Adlandırma açısında biraz akıl karıştırıcı olan bir nokta, bir aminin N-H grubunun N-M (M= metal) ile değişmesi hâlinde buna da amid denmesidir. Örneğin (CH3)2NLi, lityum dimetilamid'dir.
Hidrazin (N2H4), amonyaktaki bir hidrojen yerine NH2 (amino) grubunun geçmesi sonucunda oluşur. Hidrazindeki her bir N atomunun yükseltgenme basamağı (değerlik) -2'dir. Hidrazin bifonksiyonel bir bazdır. Susuz N2H4, dumanlar oluşturan renksiz ve yanıcı bir sıvıdır. Saf hidrazin, örneğin hidrazin hidrat gibi sulu çözelti içinde işlenmedikçe oldukça toksiktir.
Halokarbon bileşikleri, bir veya fazla karbon atomun bir veya fazla halojen atomu ile kovalent bağla birleşik kimyasallardır. Bu da organoflor bileşikler, organoklor bileşikler, organobrom bileşikler ve organoiyot bileşiklerinin oluşmasına sebep olur. Klor halokarbonları en yaygınıdır ve organoklorür olarak hitap edilir.

Karbon tetraklorür ya da tetraklorometan, CCl4 formülüne sahip bir klorokarbon. Kokusu Kloroforma benzeyen, renksiz, yanıcı olmayan, sudan ağır bir sıvıdır. Suda çözünmezken birçok organik çözücü içinde çözünür. Geçmişte soğutucu gazların üretiminde, yangın söndürücülerde lav lambalarında, temizlik malzemesi ve kurt düşürücü olarak yaygın bir şekilde kullanılmıştır.

Azot triklorür, trikloramin olarak da bilinen formülü NCl3 olan kimyasal bileşik. Sarı, yağımsı, keskin kokulu bir sıvıdır. En sık amonyak türevleri ve klor arasındaki kimyasal reaksiyon sonrası oluşmaktadır, yüzme havuzlarındaki oluşumu buna bir örnektir.
Polisülfürler kükürt atom zincirleri içeren bir sınıf kimyasal bileşiklerdir. Polisülfürler iki ana sınıfa ayrılır: anyonlar ve organik polisülfürler. Anyonlar S2−ngenel formülüne sahiptir. Bu anyonlar hidrojen polisülfürlerin H2Sn konjüge bazlarıdır. Organik polisülfürler genellikle RSnR formülüne sahiptir, burada R = alkil veya arildir.
İzopentan (C5H12),metilbütan ya da 2-metilbütan, beş karbon atomuna sahip bir dallanmış zincirli alkandır. İzopentan, oda sıcaklığında ve basıncında aşırı uçucu ve aşırı yanıcı bir sıvıdır. Aynı zamanda standart sıcaklık ve basınçta en az yoğun olan sıvıdır. Normal kaynama noktası oda sıcaklığından sadece birkaç derece yüksektir ve izopentan sıcak bir günde kolayca kaynamakta ve buharlaşmaktadır. İzopentan yaygın olarak sıvı azot ile birlikte -160 °C sıvı banyo sıcaklığına ulaşmak için kullanılır. Doğal gaz tipik olarak %1 veya daha az izopentan içerir.
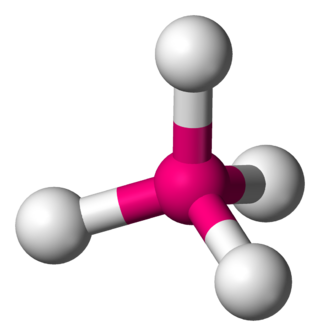
Dörtyüzlü veya tetrahedral molekül geometrisi, merkezi atomun, dört yüzlünün ortasında, dört köşede ise sübstitüentlerin yer aldığı molekül geometrisidir. Bağ açıları, dört sübstitüent aynı olduğunda (örn. metan CH4 ya da daha ağır analogları) cos−1 (-⅓) = 109,4712206 ...° ≈ 109.5° olur. Metan veya diğer simetrik yüzlü moleküller Td nokta grubuna aittir, ama dörtyüzlü moleküller genellikle düşük simetriye sahiptir. Tetrahedral moleküller kiral olabilir.
Nitrolama bir nitro grubunun organik kimyasal bileşik içine sokulması için genel bir kimyasal proses sınıfıdır. İfade daha genel olarak, ayrıca nitrogliserin sentezinde olduğu gibi alkoller ve nitrik asit arasında farklı nitrat esterleri oluşturma işlemine yanlış olarak uygulanır. Nitro bileşiklerinin ve nitratların ortaya çıkan yapısı arasındaki fark nitro bileşiklerindeki azot atomunun doğrudan oksijen olmayan bir atoma genel olarak da karbon veya başka azot atomuna bağlanmasıdır. Oysaki organik nitratlar olarak da adlandırılan nitrat esterlerinde, azot bir oksijen atomuna genellikle dolayısıyla da bir karbon atomu 'na bağlanır.
Disiyandiamid guanidinden türetilmiş bir nitrildir. Bir siyanamid dimeridir ve siyanamidden hazırlanabilir. Disiyandiamid, su, aseton ve alkolde çözünebilen renksiz bir katıdır. Polar olmayan organik çözücülerde çözünemez.
Karbanyon, karbonun üç değerlikli olduğu ve formal yükü negatif olan bir anyondur.

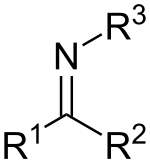
Kimyada ikili bağ veya çift bağ, iki atom arasında, tekli bağdaki iki elektrona karşılık dört bağ elektronu içeren kovalent bir bağdır. İkili bağlar en yaygın olarak iki karbon atomu arasında, örneğin alkenlerde meydana gelir. Birçok ikili bağ iki farklı element arasında bulunur: örneğin, bir karbon atomu ile bir oksijen atomu arasındaki bir karbonil grubunda. Diğer yaygın ikili bağlar azo bileşiklerinde (N=N), iminlerde (C=N) ve sülfoksitlerde (S=O) bulunur. Bir iskelet formülünde, bir ikili bağ, bağlı iki atom arasında iki paralel çizgi (=) olarak çizilir; tipografik olarak bunun için eşittir işareti kullanılır. İkili bağlar kimyasal gösterimde Rus kimyager Alexander Butlerov tarafından tanıtılmıştır.
Karbon-karbon bağı, iki karbon atomu arasındaki kovalent bir bağdır. En yaygın şekli tekli bağdır: iki atomun her birinden birer tane olmak üzere iki elektrondan oluşan bir bağ. Karbon-karbon tekli bağı bir sigma bağıdır ve karbon atomlarının her birinden bir hibridize orbital arasında oluşur. Etanda orbitaller sp3-hibridize orbitallerdir, ancak diğer hibridizasyonlara sahip karbon atomları arasında oluşan tek bağlar meydana gelir. Aslında, tekli bağdaki karbon atomlarının aynı hibridizasyona sahip olması gerekmez. Karbon atomları ayrıca alken adı verilen bileşiklerde çift bağ veya alkin adı verilen bileşiklerde üçlü bağ oluşturabilir. Bir çift bağ, sp2-hibritleşmiş bir orbital ve hibritleşmeye dahil olmayan bir p-orbitali ile oluşturulur. Üçlü bağ, sp-hibritleşmiş bir orbital ve her atomdan iki p-orbitali ile oluşturulur. P-orbitallerinin kullanımı bir pi bağı oluşturur.

Disiyanoasetilen, C
4N
2 kimyasal formülüne sahip bir karbon ve azot bileşiğidir. Alternatif üçlü ve tek kovalent bağlarla N≡C−C≡C−C≡N doğrusal bir moleküler yapıya sahiptir. İki hidrojen atomunun siyanür grupları ile değiştirildiği asetilen olarak görülebilir.