İkili bağ
Kimyada ikili bağ veya çift bağ, iki atom arasında, tekli bağdaki iki elektrona karşılık dört bağ elektronu içeren kovalent bir bağdır. İkili bağlar en yaygın olarak iki karbon atomu arasında, örneğin alkenlerde meydana gelir. Birçok ikili bağ iki farklı element arasında bulunur: örneğin, bir karbon atomu ile bir oksijen atomu arasındaki bir karbonil grubunda. Diğer yaygın ikili bağlar azo bileşiklerinde (N=N), iminlerde (C=N) ve sülfoksitlerde (S=O) bulunur. Bir iskelet formülünde, bir ikili bağ, bağlı iki atom arasında iki paralel çizgi (=) olarak çizilir; tipografik olarak bunun için eşittir işareti kullanılır.[1][2] İkili bağlar kimyasal gösterimde Rus kimyager Alexander Butlerov tarafından tanıtılmıştır.[]
Karbon içeren ikili bağlar, tekli bağlardan daha güçlü ve daha kısadır. Bağ sırası ikidir. İkili bağlar elektron bakımından da zengindir, bu da onları güçlü bir elektron alıcısının varlığında potansiyel olarak daha reaktif hale getirir (halojenlerin katılma reaksiyonlarında olduğu gibi).
- ikili bağ içeren kimyasal bileşikler
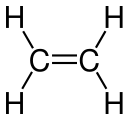 Etilen Karbon-karbon ikili bağı
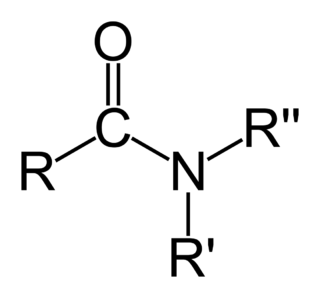
Etilen Karbon-karbon ikili bağı Aseton Karbon-oksijen ikili bağı
Aseton Karbon-oksijen ikili bağı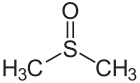 Dimetil sülfoksit Sülfür-oksijen ikili bağı
Dimetil sülfoksit Sülfür-oksijen ikili bağı Diazen Azot-azot ikili bağı
Diazen Azot-azot ikili bağı
Alkenlerde ikili bağlar

Bağlanma türü orbital hibridizasyonu açısından açıklanabilir. Etilende her karbon atomunun üç sp2 orbitali ve bir p-orbitali vardır. Üç sp2 orbitali ~120° açılı bir düzlemde yer alır. p-orbitali bu düzleme diktir. Karbon atomları birbirine yaklaştığında, sp2 orbitallerinden ikisi bir sigma bağı oluşturmak üzere üst üste biner. Aynı zamanda, iki p-orbitali yaklaşır (yine aynı düzlemde) ve birlikte bir pi bağı oluştururlar. Maksimum örtüşme için p-orbitallerinin paralel kalması gerekir ve bu nedenle merkezi bağ etrafında dönme mümkün değildir. Bu özellik cis-trans izomerizmine yol açar. İkili bağlar tek bağlardan daha kısadır çünkü p-orbital örtüşmesi maksimize edilmiştir.
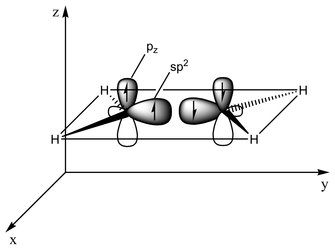 2 sp2 orbitali (toplam 3 orbital) bir sp2-sp2 sigma bağı oluşturmak üzere yaklaşır
2 sp2 orbitali (toplam 3 orbital) bir sp2-sp2 sigma bağı oluşturmak üzere yaklaşır İki p-orbitali sigma düzlemine paralel bir düzlemde bir pi-bağı oluşturmak üzere üst üste biner
İki p-orbitali sigma düzlemine paralel bir düzlemde bir pi-bağı oluşturmak üzere üst üste biner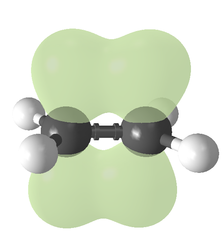 etilende pi bağı (yeşil)
etilende pi bağı (yeşil)
133 pm ile etilen C=C bağ uzunluğu, 154 pm ile etandaki C-C uzunluğundan daha kısadır. İkili bağ da daha güçlüdür, 368 kJ mol−1'e karşılık 636 kJ mol−1, ancak pi-bağı daha az etkili pi-örtüşmesi nedeniyle sigma bağından daha zayıf olduğundan iki kat daha fazla değildir.
Alternatif bir gösterimde, ikili bağ, bükülmüş bir bağda olduğu gibi üst üste binen iki sp3 orbitalinden kaynaklanır.[3]
Varyasyonlar
Alternatif ikili bağ ve tek bağ içeren moleküllerde, bir zincirdeki birden fazla atom üzerinde p-orbital örtüşmesi olabilir ve bu da konjuge bir sistemin ortaya çıkmasına neden olur. Konjugasyon dienler ve enonlar gibi sistemlerde bulunabilir. Halkalı moleküllerde konjugasyon aromatikliğe yol açabilir. Kümülenlerde iki ikili bağ bitişiktir.
İkili bağlar 2. periyot elementleri karbon, azot ve oksijen için yaygındır ve daha yüksek periyotlardaki elementlerde daha az yaygındır. Metaller de bir metal ligand çoklu bağında çoklu bağ yapabilir.
Grup 14 alken homologları
İkili bağlı bileşikler, alken homologları, R2E=ER2 artık tüm ağır grup 14 elementleri için bilinmektedir. Alkenlerden farklı olarak bu bileşikler düzlemsel değil, bükülmüş ve/veya trans bükülmüş yapıları benimserler. Bu etkiler daha ağır elementler için daha belirgin hale gelir. (Me3Si)2CHSn=SnCH(SiMe3)2 distanneni, tek bir bağdan biraz daha kısa bir kalay-kalay bağ uzunluğuna, her bir kalay atomunda piramidal koordinasyona sahip trans bükülmüş bir yapıya sahiptir ve çözeltide kolayca ayrışarak (Me3Si)2CHSn: (stannanedil, bir karben analoğu) oluşturur. Bağlanma, her bir kalay atomu üzerindeki yalnız çiftin diğerindeki boş p orbitali ile örtüştüğü iki zayıf donör alıcı bağından oluşur.[4][5] Bunun aksine, disilenlerde her bir silikon atomu düzlemsel koordinasyona sahiptir ancak sübstitüentler bükülmüştür, böylece molekül bir bütün olarak düzlemsel değildir. Diplumbenlerde Pb=Pb bağ uzunluğu, karşılık gelen birçok tek bağdan daha uzun olabilir.[5] Plumbenler ve stannenler genellikle çözeltide karşılık gelen tek bağların sadece bir kısmı olan bağ entalpilerine sahip monomerlere ayrışır. Bazı ikili bağlar plumbenler ve stannenler hidrojen bağlarına benzer güçtedir.[4] Carter-Goddard-Malrieu-Trinquier modeli, bağın doğasını tahmin etmek için kullanılabilir.[4]
Atomlar arasındaki ikili bağ türleri
| C | Ö | N | S | Si | Ge | sn | kurşun | |
|---|---|---|---|---|---|---|---|---|
| C | alken | karbonil grubu | imin | tiyoketon, tial | ||||
| O | dioksijen | nitrozo bileşiği | sülfoksit, sülfon, sülfinik asit, sülfonik asit | |||||
| N | azo bileşiği | |||||||
| S | disülfür | |||||||
| Si | alkidensilanlar | silenler | ||||||
| Ge | germeneler | |||||||
| Sn | stannenler | |||||||
| Pb | plumbeneler |
Kaynakça
- ^ Advanced organic chemistry : reactions, mechanisms, and structure (3.3soyadı=March, Jerry, 1929-1997. bas.). New York: Wiley. 1985. ISBN 0-471-88841-9. OCLC 10998226. 10 Aralık 2019 tarihinde kaynağından arşivlendi. Erişim tarihi: 12 Aralık 2020.
- ^ McMurry, John. Organic chemistry (Ninth bas.). Boston, MA, USA. ISBN 978-1-305-08048-5. OCLC 907259297. 4 Nisan 2024 tarihinde kaynağından arşivlendi. Erişim tarihi: 12 Aralık 2020.
- ^ Carey, Francis A., 1937- (2007). Advanced organic chemistry (5.5diğerleri=Sundberg, Richard J., 1938- bas.). New York: Springer. ISBN 978-0-387-44897-8. OCLC 154040953. 4 Nisan 2024 tarihinde kaynağından arşivlendi. Erişim tarihi: 12 Aralık 2020.
- ^ a b c Power, Philip P. (1999). "π-Bonding and the Lone Pair Effect in Multiple Bonds between Heavier Main Group Elements". Chemical Reviews. 99 (12): 3463-3504. doi:10.1021/cr9408989. PMID 11849028.
- ^ a b Wang, Yuzhong; Robinson, Gregory H. (2009). "Unique homonuclear multiple bonding in main group compounds". Chemical Communications. Royal Society of Chemistry (35): 5201-5213. doi:10.1039/B908048A. PMID 19707626.
- Pyykkö, Pekka; Riedel, Sebastian; Patzschke, Michael (2005). "Triple-Bond Covalent Radii". Chemistry: A European Journal. 11 (12): 3511-20. doi:10.1002/chem.200401299. PMID 15832398.