İdeal gaz yasası
| Termodinamik |
|---|
 |

İdeal gaz yasası, sadece teoride olan ideal gazların durumları hakkında denklemler sağlayan bir yasadır. Bir miktar gazın durumu; basıncı, hacmi ve sıcaklığına göre belli olur. Bu denklem aşağıdaki gibidir:
- P paskal olarak basınç,
- V kübik metre olarak hacim,
- n gazın mol sayısı,
- R gaz sabiti (8.3145 J/(mol K))
- T Kelvin olarak sıcaklık
İdeal gaz sabiti (R), kullanılan birimlere göre değişir. Yukarıda verilen değer (8.3145), SI birimleri için, yani paskal-kübik metre-molar-kelvin için hesaplanmıştır.
İdeal gaz yasası, en çok monatomik gazlar için geçerlidir ve yüksek sıcaklık, alçak basınçlarda daha iyi sonuçlar verir. Bu formül, her gaz molekülünün boyutunu ya da moleküller arası bağları dikkate almadığından, bunları da dikkate alan van der Waals denklemi daha iyi sonuçlar verir.
Alternatif halleri
Mol sayısı (n), kütle olarak da verilebileceği için, bazen bu denklemin alternatif hali daha kullanışlı olabilir. Bu özellikle bilinen bir gaz sorulduğunda kolaylık sağlar.
Mol sayısının (n), kütlenin (m) molar kütleye (M) bölünmesine eşit olduğunu düşünün:
Bunu, n ile yer değiştirirsek:
Termodinamik ve fizik alanlarında, bir şey spesifik olması gerekiyorsa, bu değerlerin birim başına düşen kütle halinde verilmesi gerektiği anlamına gelir. Bu durumda spesifik gaz sabiti (r), gaz sabitinin (R) molar kütleye (M) bölünmesi anlamına gelir:
- ya da
Bu durumda, yukardaki formüle r eklenmek istense, aşağıdaki formül ortaya çıkar:
Yoğunluk (ρ) kütlenin hacme oranı olduğundan, hacim kütleyle yer değiştirirse (V = g/ρ), benzer bir formül yazılabilir.
Kanıt
Uygulamalı
İdeal gaz yasası, Boyle yasası, Charles yasası ve Gay-Lussac yasası kullanılarak kanıtlanılabilir.
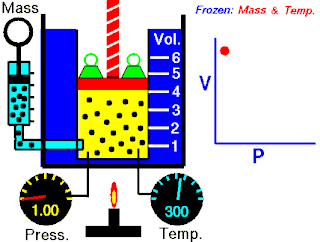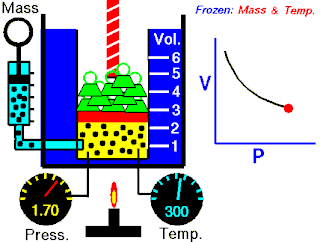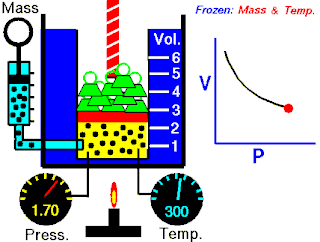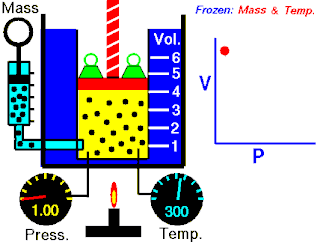
Herhangi bir hacimde (V) bir gaz düşünülürse, hali aşağıdaki gibi belirtilebilir:
- = 100 kPa
- = 290 K
Öncelikle, gaz izobarik bir işleme uğrarsa, son hacmi aşağıdaki gibi olur:
ve de sıcaklığı olur.
İkinci olarak, daha sonra izotermik bir işleme uğrarsa, hali aşağıdaki gibi olur:
Sonuç olarak:
- ;
- ;
- ;
Burada, adı verilen , evrensel gaz sabitidir. Bunu kullanarak:
Ve denklemin iki kısmını da n (mol sayısı) ile çarparsak:
sembolünü, için kısaltma olarak kullanırsak aşağıdaki sonucu elde ederiz:
Teorik
İdeal gaz yasası, ayrıca, kinetik teoriyi kullanarak kanıtlanılabilir. Bunda, durumu basitleştirmek için bazı varsayımların yapıldığı unutulmamalıdır. Bunların arasında en önemlisi şudur: Bir gazın molekülleri ya da atomları bir kütleye sahip olsalar da yok sayılabilirler.