
Fizikte enerji, bir cisime veya fiziksel bir sisteme aktarılan, işin performansında ve ısı ve ışık biçiminde tanınabilen niceliksel özelliktir. Enerji korunan bir miktardır; Enerjinin korunumu yasası, enerjinin istenen biçime dönüştürülebileceğini ancak yaratılamayacağını veya yok edilemeyeceğini belirtir. Uluslararası Birimler Sisteminde (SI) enerjinin ölçü birimi joule'dür (J).
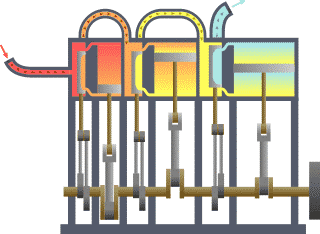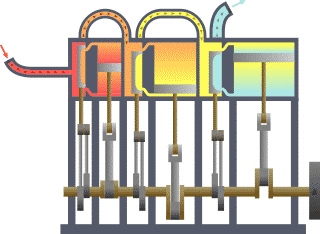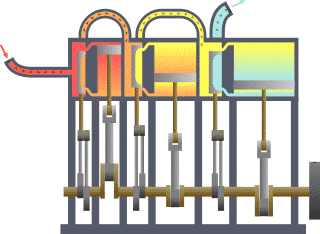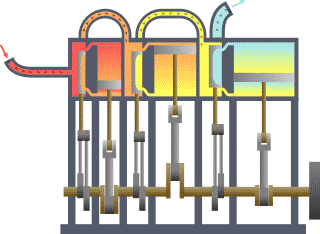
Termodinamik; ısı, iş, sıcaklık ve enerji arasındaki ilişki ile ilgilenen bilim dalıdır. Basit bir ifadeyle termodinamik, enerjinin bir yerden başka bir yere ve bir biçimden başka bir biçime transferi ile ilgilenir. Bu süreçteki anahtar kavram, ısının, belirli bir mekanik işe denk gelen bir enerji biçimi olmasıdır.

Entalpi, maddenin yapısında depoladığı her türden enerjilerin toplamıdır. H ile simgelenir. Bir mol maddede depolanmış enerjiye o maddenin molar entalpisi denir.
Kalorimetre, kalorimetri biliminde kullanılan cihaza veya bir kimyasal reaksiyonda ya da fiziksel değişim'de açığa çıkan ısıyı ve ısı sığasını ölçme işlemine verilen isimdir. Diferansiyel taramalı kalorimetre (DSC), izotermal titrasyon kalorimetresi (ITC) ve hızlandırılmış oran kalorimetresi en bilinen çeşitleridir.

Termodinamik çevrim, bir veya daha çok hal değişimi gerçekleştiren, iş veya enerji üreterek veya enerjiyi transfer ederek ilk haline dönen bir çalışma akışkanı içeren çevrimlerdir. Tabloda termodinamik çevrimlerin listesi verilmiştir.

Genleşme, sıcaklığı artırılan bir cismin uzunluk ya da hacminin değişmesi olayıdır.
Termodinamiğin(Isıldevinimin) ikinci yasası, izole sistemlerin entropisinin asla azalamayacağını belirtir. Bunun sebebini izole sistemlerin termodinamik dengeden spontane olarak oluşmasıyla açıklar. Buna benzer olarak sürekli çalışan makinelerin ikinci kanunu imkânsızdır.

Enerjinin korunumu yasası, yalıtılmış bir sistemdeki toplam enerjinin değişmeyeceğini söyler. Enerji ne yok edilebilir ne de yoktan var edilebilir, ama enerji türü değişebilir; örneğin, dinamitin patlamasıyla kimyasal enerji kinetik enerjiye dönüşebilir.

Termodinamik yasaları, termodinamiğin temelini oluşturan dört yasadır. Termodinamik proseslerdeki ısı ve iş transferlerinin yapısını tanımlar.

Gibbs serbest enerjisi entalpiden, entropi ve mutlak sıcaklığın çarpımının çıkarılmasıyla elde edilen termodinamik bir değişkendir. Genel olarak kimyasal bir reaksiyonun enerji potansiyelinin işe dönüştürülebilmesiyle ilgilidir.

Enerji biçimleri, iki ana grubu ayrılabilir: kinetik enerji ve potansiyel enerji. Diğer enerji türleri bu iki enerji türünün karışımdan elde edilir.

Esneklik enerjisi, bir maddenin veya fiziksel bir sistemin bünyesinde depolanan ve hacmini veya şeklini bozmak için gereken işin potansiyel mekanik enerjidir. Katı mekaniği önceleri, katı cisim ve maddenin anlaşılması için geliştirilmiş bilim dalıdır. Esneklik potansiyel enerjisi eşitliği, mekanik dengenin pozisyonunu hesaplamak için kullanılır. Enerji potansiyeldir ve kinetik enerji gibi başka enerji biçimlerine dönüştürülebilir. Eşitlik matematiksel olarak şöyle gösterilir

Kimyada kimyasal enerji, pil, ampul ve hücre gibi bir kimyasal maddenin tepkime esnasındaki değişiminin potansiyelidir. Kimyasal bağ kurma veya koparma sonucu enerji açığa çıkar. Bu enerji bir kimyasal sistem tarafından ya emilir ya da yayılır.
Fizikte, foton gazı, fotonların gaz benzeri birikmesidir ki hidrojen ve neon gibi sıradan gazlarla basınç, sıcaklık, entropi gibi benzer özelliklere sahiptir. Foton gazının dengedeki en yaygın örneği siyah cisim ışımasıdır.
Gibbs-Helmholtz denklemi Sıcaklık'ın bir fonksiyonu olarak bir sistemin Gibbs enerjisi içindeki değişikliklerini hesaplamak için kullanılan termodinamik denklemdir. Adını Josiah Willard Gibbs ve Hermann von Helmholtz'den almıştır.
Bir sürecin spontaneliği, bir reaksiyonun Gibbs serbest enerjisi değeri nedeniyle, bir enerji girişi olmadan meydana gelip gelmeyeceğini ifade eder.
Çözülme, çözücünün moleküller ile etkileşimini tanımlar. Hem iyonize hem de yüksüz moleküller, çözücü ile güçlü bir şekilde etkileşir ve bu etkileşimin gücü ve doğası, çözücünün viskozite ve yoğunluk gibi özelliklerini etkilemenin yanı sıra çözünürlük, reaktivite ve renk dahil olmak üzere çözülen maddenin birçok özelliğini etkiler. Çözülme sürecinde iyonlar eş merkezli bir çözücü kabuğu ile çevrelenir. Çözülme, çözücü ve çözünen moleküllerin çözünme kompleksleri halinde yeniden düzenlenmesi sürecidir.

Termodinamik serbest enerji, mühendislik ve bilimdeki kimyasal veya termal süreçlerin termodinamiğinde kullanılan bir kavramdır. Serbest enerjideki değişim, bir termodinamik sistemin sabit sıcaklıktaki bir süreçte yapabileceği maksimum iş miktarıdır ve işareti, işlemin termodinamik olarak uygun mu yoksa yasak mı olduğunu gösterir. Serbest enerji genellikle potansiyel enerji içerdiğinden mutlak değildir ve bu nedenle sıfır noktası seçimine bağlıdır. Bu nedenle yalnızca bağıl serbest enerji değerleri veya serbest enerjideki değişimler fiziksel olarak anlamlıdır.
Termodinamikte izovolümetrik süreç veya izometrik süreç olarak da adlandırılan izokorik süreç kapalı sistem hacminin sabit kalması demektir. İzokorik bir süreç, kapalı, elastik olmayan bir kabın içeriğinin ısıtılması veya soğutulması ile örneklendirilebilir. Kapalı sistem kabın içeriğinin dışarıya karşı izole olmasıdır. Kap deforme olmaz ve hacmi termodinamik süreç boyunca sabit kalırsa bu bir izokorik süreç örneğidir.

























