
Çinko, sembolü Zn, atom numarası 30 olan kimyasal bir elementtir. Oda sıcaklığında hafif kırılgan bir metaldir ve oksidasyon giderildiğinde parlak gri bir görünüme kavuşur. Periyodik tablonun 12. (IIB) grubunun ilk elementidir. Bazı açılardan çinko kimyasal olarak magnezyuma benzer: her iki element de yalnızca bir normal oksidasyon durumu (+2) gösterir ve Zn2+ ve Mg2+ iyonları benzer boyuttadır. Çinko, Dünya kabuğundaki en bol bulunan 24. element olup beş kararlı izotopu vardır. En yaygın çinko cevheri, bir çinko sülfür minerali olan sfalerittir.

Kral suyu, asitlerin az etki ettiği ya da etki etmediği altın ve platin gibi metallerle tepkimeye girebilen kuvvetli bir asit çözeltisidir. Hidroklorik asit ve nitrik asitin 3:1 oranında karıştırılmasıyla oluşur. Ebu Musa Câbir bin Hayyan tarafından bulunduğu tahmin edilmektedir.

Potasyum nitrat, formülü KNO3 olan bir potasyum bileşiğidir. Güherçile olarak da bilinen bileşik doğal hâlde kayaçlarda ve mağaralarda oluşan beyaz renkli kabuksu yapıda bulunur.
Nitrik asit, HNO3 kimyasal formülüne sahip oldukça aşındırıcı bir inorganik asittir. Kezzap olarak da bilinir. Saf hâldeki bileşik renksizdir. Ancak uzun süre bekleyen eski asitler azot oksitleri ve suya ayrışması nedeniyle sarı renge dönebilme özelliğindedirler. Piyasada bulunan nitrik asitlerin çoğu % 68'lik bir konsantrasyona sahiptir. Çözelti, %86'dan fazla HNO3 içerdiğinde, dumanlı nitrik asit olarak adlandırılır. Mevcut azot dioksit miktarına bağlı olarak, dumanlı nitrik asit ayrıca %86’nın üzerindeki konsantrasyonlarda kırmızı dumanlı nitrik asit veya %95’in üzerindeki konsantrasyonlarda beyaz dumanlı nitrik asit olarak tanımlanır.

Küprik sülfat ya da sadece bakır sülfat olarak da bilinen Bakır (II) sülfat, kimyasal formülü CuSO4 olan bir kimyasal bileşiktir. Bu tuzun hidrasyon derecelerine bağlı olarak bir dizi farklı bileşikleri mevcuttur. Susuz formu soluk yeşil ya da grimsi beyaz bir toz olmasına karşın en çok bilinen pentahidrat (CuSO4•5H2O) formu, parlak mavi renktedir. Çok az miktardaki CuSO4•5H2O çevreye çok zehirlidir, gözleri ve cildi tahriş eder ve yutulduğunda zararlı da olabilir. Oktahedral moleküler geometriye ve paramanyetik özelliğe sahip olan bakır (II) sülfat ekzotermik olarak suda çözünürek [Cu(H2O)6]2+ kompleksini oluşturur. Bakır (II) sülfat "mavi vitriyol", "göztaşı" ve "göktaşı" olarak da bilinmektedir.

Gümüş nitrat en önemli gümüş tuzudur. Renksiz ağır kristallerden oluşur. Tıpta dağlamak maksadıyla kullanılır ve antibakteriyel özelliği vardır. Bu özelliğinden dolayı siğil tedavisinde sıkça kullanılır. Ayrıca deriyi ve organik maddeleri karartmada tercih edilir. Deriyi kararttığından cehennem taşı ismini almıştır. Suda ve alkolde kolayca çözündüğünden birçok gümüş bileşiklerinin elde edilmesinde ilkel madde olarak kullanılır. En çok kullanıldığı yerler, başta fotoğrafçılık olmak üzere mürekkepler, saç boyası yapımı ve gümüş kaplamacılığıdır.bileşenleri gümüş ve nitrik asittir. Sentezi ise örnekteki formüle göre yapılır:
- Ag + 2 HNO3 → AgNO3 + NO2 + H2O
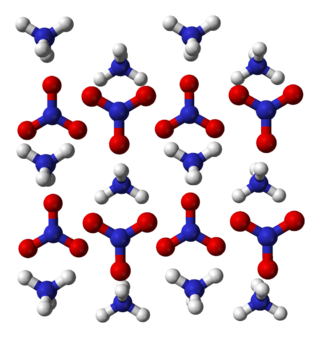
Amonyum nitrat, amonyum ve nitrat iyonlarından oluşan, NH4NO3 formülüne sahip yüksek patlayıcı bir kimyasal bileşiktir. Higroskopik özellikte ve beyaz kristal bir katı olarak hidrat oluşturmasa da suda çok çözünür. Ağırlıklı olarak, tarımda yüksek azotlu gübre olarak kullanılmaktadır. 2017 yılında küresel üretimi 21.6 milyon ton olarak tahmin edildi.

Sodyum nitrat formülü NaNO3 olan kimyasal bileşiktir. Güherçile'den ayırmak için Şili güherçilesi (bu ülkede büyük miktarda yığınlar halinde bulunması nedeniyle bu ad verilmiştir) adı da verilen bu beyaz renkli kristal tuz, potasyum nitrata oranla suda çok fazla çözünmektedir. Havadan nem çeker.
Stronsiyum nitrat formülü Sr(NO3)2 olan inorganik bileşiktir. Beyaz kristallere sahip bu bileşik piroteknik bileşimlerde kırmızı renk vermek için kullanılır.

Kripton diflorür, KrF2 kripton ve florun oluşturduğu kimyasal bileşiktir. Keşfedilen ilk kripton bileşiği olan kripton diflorür uçucu renksiz bir katıdır. KrF2'nin yapısı lineerdir ve Kr-F mesafesi 188,9 pm'dir. Güçlü Lewis asitleri ile reaksiyona girerek KrF+ ve Kr2F3+ katyon tuzlarını oluşturur. KrF2 en kolay ve en fazla üretilebilen kripton bileşiğidir. Oldukça güçlü bir oksitleyici ajan olan kripton diflorür, ksenonu ksenon hekzaflorüre veya iyotu iyot pentaflorüre dönüştürebilme kabiliyetine sahiptir. Bu oksidant özelliği ile florürleri ve altını oksitlemede kullanılır.
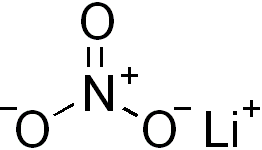
Lityum nitrat LiNO3 formüllü inorganik bileşik. Nitrik asitin lityum tuzudur. Lityum karbonat veya lityum hidroksitin nitrik asit ile reaksiyonundan elde edilir.

Azot pentaoksit N2O5 formüllü kimyasal bileşik. Diazot pentaoksit olarak da bilinir. Sadece azot ve oksijen içeren azot oksit ailesinin ikili bileşiklerinden biridir. Kararsız ve potansiyel oksitleyicidir.

Çinko bromür (ZnBr2), ZnBr2 kimyasal formülüne sahip bir inorganik bileşiktir. Renksiz bir tuzdur ve çinko klorür (ZnCl2) ile pek çok ortak özellik taşır; organik çözücüler içinde çözünürler ve asiditesi yüksek çözeltiler oluşturmak üzere, su içinde yüksek çözünürlüğe sahiptirler. Higroskopiktir ve 2H2O·ZnBr2 dihidratını oluşturur.

Çinko siyanür, Zn(CN)2 formüllü ile gösterilen bir inorganik bileşiktir. Esas olarak çinko kaplamada kullanılan beyaz renkli bir katıdır, ancak organik bileşiklerin sentezi için daha özel uygulamalara da sahiptir.

Bromöz asit, HBrO2 formülüne sahip bir inorganik bileşiktir. Konjugat bazının -bromitlerinin- tuzları izole edilmiş olmasına rağmen, kararsız bir bileşiktir. Asidik çözeltide, bromitler broma ayrışır.

Bakır (II) nitrat Cu(NO3)2(H2O)x formülüne sahip inorganik bileşikler ailesinin herhangi bir üyesini tanımlar. Hidratlar mavi katılardır. Susuz bakır nitrat mavi-yeşil kristaller oluşturur ve 150-200 °C'de vakumda süblimleşir. Yaygın hidratlar hemipentahidrat ve trihidrattır.
Nitrolama bir nitro grubunun organik kimyasal bileşik içine sokulması için genel bir kimyasal proses sınıfıdır. İfade daha genel olarak, ayrıca nitrogliserin sentezinde olduğu gibi alkoller ve nitrik asit arasında farklı nitrat esterleri oluşturma işlemine yanlış olarak uygulanır. Nitro bileşiklerinin ve nitratların ortaya çıkan yapısı arasındaki fark nitro bileşiklerindeki azot atomunun doğrudan oksijen olmayan bir atoma genel olarak da karbon veya başka azot atomuna bağlanmasıdır. Oysaki organik nitratlar olarak da adlandırılan nitrat esterlerinde, azot bir oksijen atomuna genellikle dolayısıyla da bir karbon atomu 'na bağlanır.

Magnezyum nitrat Mg(NO3)2(H2O)x formülüne sahip inorganik bileşikleri ifade eder. Formüldeki, x = 6, 2 ve 0 olabilir. Hepsi beyaz renkli katılardır. Susuz madde higroskopiktir, havada bekletildiğinde hızlı bir şekilde hekzahidrat oluşturur. Bütün tuzları hem suda hem de etanolde çok çözünür.

Mangan(II) nitrat Mn(NO3)2•(H2O)n formülüne sahip bir inorganik bileşiktir. Her formül birimi bir Mn2+ katyon ve iki NO3− anyonu ile değişen miktarlarda sudan oluşur. En yaygın olanı tetrahidrat Mn(NO3)2•4H2O dır. Fakat, susuz bileşiğin yanı sıra mono ve hekzahidratlar da bilinmektedir. Bu bileşiklerin bazıları, mangan oksitleri için faydalı öncül maddelerdir.
Gümüş asetilür, formülü Ag2C2 olan bir metalik asetilür, inorganik kimyevi bileşiktir. Gümüş karbür olarak da bilinir. Nileşik, zayıf bir asit olan asetilenin tuzu olarak kabul edilir. Tuzun anyonu birbirine üçlü bağla bağlanmış iki karbon atomundan oluşur.

















