Çinko klorür
Çinko klorür, ZnCl2·nH2O formülüne sahip, n değeri 0 ila 4,5 arasında değişen hidratlar oluşturan inorganik bir kimyasal bileşiktir. Susuz çinko klorür ve hidratları renksiz veya beyaz kristal katılardır ve suda oldukça çözünür. Beş çinko klorür hidratının yanı sıra dört susuz çinko klorür formu bilinmektedir.[1] Çinko klorürün tüm formları nem çeker. Çinko klorür tekstil işlemede, metalurjik akılarda ve kimyasal sentezde geniş uygulama alanı bulur.[1]
Yapı ve özellikler
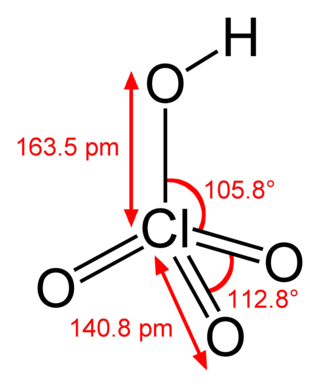
Diğer metal dihalojenürlere göre çinko diklorürün çeşitli kristal formlar (polimorflar) oluşturması alışılmadık bir durumdur. Dört tanesi bilinmektedir: α, β, γ ve δ. Her durumda Zn2+ tetrahedral merkezleri bulunur.[2]
| Biçim | Kristal sistemi | Pearson sembolü | Uzay grubu | no. | ''a'' (nm) | b (nm) | c (nm) | Z | Yoğunluk (g/ cm3 ) |
|---|---|---|---|---|---|---|---|---|---|
| a | dörtgen | tI12 | ben 4 2d | 122 | 0,5398 | 0,5398 | 0.64223 | 4 | 3.00 |
| β | dörtgen | tP6 | P4 2 /nmc | 137 | 0,3696 | 0,3696 | 1.071 | 2 | 3.09 |
| γ | monoklinik | MP36 | P2 1 /c | 14 | 0,654 | 1.131 | 1.23328 | 12 | 2.98 |
| δ | ortorombik | oP12 | Pna2 1 | 33 | 0,6125 | 0.6443 | 0,7693 | 4 | 2.98 |
Burada a, b ve c kafes sabitleridir, Z birim hücre başına yapı birimi sayısıdır ve ρ yapı parametrelerinden hesaplanan yoğunluktur.[3][4][5]
Ortorombik form (δ), atmosfere maruz kaldığında hızla diğer formlardan birine dönüşür.[2] Erimiş maddenin hızlı soğutulması bir cam verir.[6]
Hazırlanması ve saflaştırma
Tarihte çinko klorürler, hidroklorik asidin çinko metali veya çinko oksit ile reaksiyonundan hazırlanırdı. Sulu asitler susuz çinko klorür üretmek için kullanılamaz. Eski bir prosedüre göre, dietil eter içindeki toz hâldeki çinko süspansiyonu hidrojen klorür ile işlenir ve ardından kurutulur.[7] Genel yöntem çözücü olmadan hâlâ endüstride kullanılır:[1]
- Zn + 2 HCl → ZnCl
2 + H
2
Sulu çözeltiler, Zn metali, çinko karbonat, çinko oksit ve çinko sülfürün hidroklorik asit ile işlenmesiyle benzer şekilde kolayca hazırlanabilir:[8]
- ZnS + 2 HCl + 4 H
2O → ZnCl
2(H
2O)
4 + H
2S
Organik sentezde çinko klorür
Çinko klorür, sıklıkla bir Lewis asidi olarak kullanılan bir laboratuvar reaktifidir. Dramatik bir örnek, çözücü ve katalizör olarak çinko klorür kullanılarak metanolün hekzametilbenzene dönüştürülmesidir:[9]
- 15 CH
3OH → C
6(CH
3)
6 + 3 CH
4 + 15 H
2O
Lewis asidi olarak çinko klorür örnekleri arasında Fischer indol sentezi yer alır:[10]
Çinko klorür ayrıca benzilik ve alilik halojenürleri, alkenler gibi zayıf nükleofillerin eklenmesine yönelik olarak aktive eder:[11]

Kullanım alanları
Endüstriyel organik kimya
Çinko klorür, endüstriyel ölçekte gerçekleştirilen çeşitli reaksiyonlarda katalizör veya reaktif olarak kullanılır. Batılı ülkelerde yılda 20.000 ton üretilen benzaldehit, çinko diklorürün katalitik özelliklerinden yararlanılarak, nispeten ucuz olan toluenden üretilmektedir. Bu işlem, benzal klorür vermek üzere toluenin klorlanmasıyla başlar. Az miktarda susuz çinko klorür varlığında, benzal klorür karışımı aşağıdaki stokiyometriye göre sürekli olarak su ile işlenir:[12]
- C
6H
5CHCl
2 + H
2O → C
6H
5CHO + 2 HCl
Benzer şekilde çinko klorür, benzoil klorüre giden ana yol olan benzotriklorürün hidrolizinde kullanılır. Metilen-bis(ditiyokarbamat) üretimi için katalizör görevi görür.[1]
Metalurjik bir akı olarak
Çinko klorürün bir akı maddesi olarak, bazen amonyum klorür ile bir karışım hâlinde kullanılması (ayrıca bkz. Çinko amonyum klorür ), HCl'nin üretimini ve bunun yüzey oksitleri ile müteakip reaksiyonunu içerir.
Çinko klorür, amonyum klorür ile iki tuz oluşturur: [NH
4]
2[ZnCl
4] ve[NH
4]
3[ZnCl
4]Cl, tıpkı çinko klorür hidratın yaptığı gibi, ısıtıldığında ayrışarak HCl salar. Örneğin sıcak daldırmalı galvanizleme işleminde çinko klorür/amonyum klorür akılarının etkisi, H
2 ve amonyak gazı üretir.[13]
Tarihi
Çinko klorür uzun süredir bilinmekteydi, ancak şu anda kullanıldığı endüstriyel uygulamaların tümü 20. yüzyılın ikinci yarısında geliştirilmiştir.[1]
Güvenlik
Çinko ve klorür yaşam için gereklidir. Zn2 + çeşitli enzimlerin, örneğin karboksipeptidaz ve karbonik anhidrazın bir bileşenidir. Bu nedenle çinko klorürlerin sulu çözeltileri nadiren akut zehirlenmelere neden olur.[1] Ancak susuz çinko klorür cildi ve diğer dokuları yakabilen agresif bir Lewis asididir. Çoğunlukla lehim akısından kaynaklanan çinko klorürün yutulması endoskopik kontrol gerektirir.[14] Çinko klorürün başka bir kaynağı da sis bombalarında kullanılan çinko klorür duman karışımıdır ("HC"). Çinko oksit, hekzakloroetan ve alüminyum tozu içeren çinko klorür, karbon ve alüminyum oksit dumanı yayarak etkili bir sis perdesi oluşturur.[15] Bu tür sis perdeleri ölümlere yol açabilir.[16]
Kaynakça
Dış bağlantılar
- ^ a b c d e f Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a28_537. Kaynak hatası: Geçersiz
<ref>etiketi: "a" adı farklı içerikte birden fazla tanımlanmış (Bkz: ) - ^ a b Wells, A. F. (1984). Structural Inorganic Chemistry. Oxford: Clarendon Press. ISBN 978-0-19-855370-0.
- ^ Oswald, H. R.; Jaggi, H. (1960). "Zur Struktur der wasserfreien Zinkhalogenide I. Die wasserfreien Zinkchloride". Helvetica Chimica Acta. 43 (1): 72-77. doi:10.1002/hlca.19600430109.
- ^ Brynestad, J.; Yakel, H. L. (1978). "Preparation and Structure of Anhydrous Zinc Chloride". Inorganic Chemistry. 17 (5): 1376-1377. doi:10.1021/ic50183a059.
- ^ Brehler, B. (1961). "Kristallstrukturuntersuchungen an ZnCl2". Zeitschrift für Kristallographie. 115 (5–6): 373-402. doi:10.1524/zkri.1961.115.5-6.373.
- ^ Mackenzie, J. D.; Murphy, W. K. (1960). "Structure of Glass-Forming Halides. II. Liquid Zinc Chloride". The Journal of Chemical Physics. 33 (2): 366-369. doi:10.1063/1.1731151.
- ^ Hamilton, R. T.; Butler, J. A. V. (1932). "Notes: The Preparation of Pure Zinc Chloride". Journal of the Chemical Society (Resumed): 2283-4. doi:10.1039/JR9320002282.
- ^ Goodwin, Frank E. (2017). "Zinc Compounds". Kirk-Othmer Encyclopedia of Chemical Technology. ss. 9-10. doi:10.1002/0471238961.2609140307151504.a02.pub3. ISBN 978-0-471-23896-6.
- ^ Chang, Clarence D. (1983). "Hydrocarbons from Methanol". Catal. Rev. - Sci. Eng. 25 (1): 1-118. doi:10.1080/01614948308078874.
- ^ Organic Syntheses. doi:10.15227/orgsyn.022.00981955. Eksik ya da boş
|başlık=(yardım) - ^ Bauml, E.; Tschemschlok, K.; Pock, R.; Mayr, H. (1988). "Synthesis of γ-Lactones from Alkenes Employing p-Methoxybenzyl Chloride as +CH2-CO2− Equivalent" (PDF). Tetrahedron Letters. 29 (52): 6925-6926. doi:10.1016/S0040-4039(00)88476-2. 27 Ekim 2022 tarihinde kaynağından arşivlendi (PDF). Erişim tarihi: 20 Temmuz 2024.
- ^ Brühne, Friedrich; Wright, Elaine (2011). "Benzaldehyde". Ullmann's Encyclopedia of Industrial Chemistry. doi:10.1002/14356007.a03_463.pub2. ISBN 978-3-527-30385-4.
- ^ American Society for Metals (1990). ASM handbook. ASM International. ISBN 978-0-87170-021-6.
- ^ Hoffman, Robert S.; Burns, Michele M.; Gosselin, Sophie (2020). "Ingestion of Caustic Substances". New England Journal of Medicine. 382 (18): 1739-1748. doi:10.1056/nejmra1810769. PMID 32348645.
- ^ Sample, B. E. (1997). Methods for Field Studies of Effects of Military Smokes, Obscurants, and Riot-control Agents on Threatened and Endangered Species. DIANE Publishing. ISBN 978-1-4289-1233-5.
- ^ Gunnar F. Nordberg, Bruce A. Fowler, Monica Nordberg, (Ed.) (2015). Handbook on the Toxicology of Metals. Academic Press. doi:10.1016/C2011-0-07884-5. ISBN 978-0-444-59453-2. r eksik
|soyadı1=(yardım)