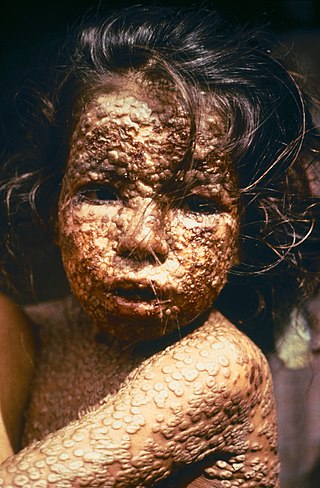
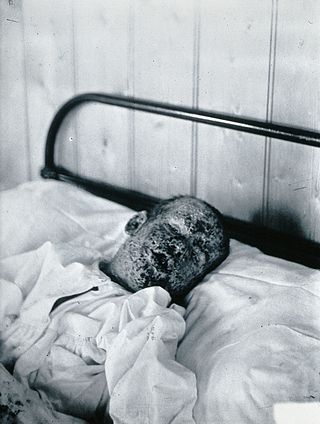
Çiçek virüsü
| Variola virus | |||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
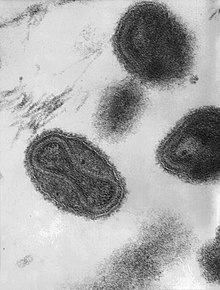 Bu transmisyon elektron mikrografı bir dizi çiçek virionunu göstermektedir. Virionun içindeki "dambıl şeklindeki" yapı, viral DNA'yı içeren viral çekirdektir; Mag. = ~370.000× | |||||||||||||||||
| Virüs sınıflandırması | |||||||||||||||||
| |||||||||||||||||
Çiçek virüsü veya Variola virus Poxviridae familyasına, Chordopoxvirinae alt familyasına, Orthopoxvirus cinsine ait olan bir DNA virüsüdür ve çiçek hastalığına sebep olur.
Evrim
Çiçek hastalığının ortaya çıkış tarihi kesin değildir. Büyük olasılıkla 68.000 ila 16.000 yıl önce karasal bir Afrika kemirgen virüsünden evrimleşmiştir.[2] Geniş tarih aralığı, moleküler saati kalibre etmek için kullanılan farklı kayıtlardan kaynaklanmaktadır. Bir klad, 400 ila 1600 yıl önce Asya'dan yayılan variola majör suşlarıydı (çiçek hastalığının klinik olarak daha şiddetli formu). İkinci bir klad, Amerika kıtalarından tanımlanan alastrim (fenotipik olarak hafif bir çiçek hastalığı) ve günümüzden 1400 ila 6300 yıl önce atasal bir türden farklılaşan Batı Afrika'dan izolatları içeriyordu. Bu klad en az 800 yıl önce iki alt klana ayrılmıştır.[3]
İkinci bir tahmin variola virüsünün Taterapox'tan (gerbiller dahil bazı Afrika kemirgenlerinde görülen bir Orthopoxvirus) ayrılışını 3000 ila 4000 yıl öncesine dayandırmaktadır.[4] Bu, çiçek hastalığının bir insan hastalığı olarak ortaya çıkışına ilişkin arkeolojik ve tarihi kanıtlarla tutarlıdır ve nispeten yeni bir kökene işaret etmektedir. Mutasyon oranının herpesvirüslerinkine benzer olduğu varsayılırsa, variola virüsünün Taterapox'tan ayrılma tarihinin 50.000 yıl önce olduğu tahmin edilmektedir.[4] Bu, yayınlanan diğer tahminlerle tutarlı olmakla birlikte, arkeolojik ve tarihi kanıtların çok eksik olduğunu göstermektedir. Bu virüslerdeki mutasyon oranlarının daha iyi tahmin edilmesi gerekmektedir.
Yaklaşık 1650 yılına ait bir suşun incelenmesi, bu suşun halihazırda dizilenmiş diğer suşlara bazal olduğunu ortaya koymuştur.[5] Bu virüsün mutasyon oranı moleküler saat ile iyi bir şekilde modellenmiştir. Suşların çeşitlenmesi yalnızca 18. ve 19. yüzyıllarda meydana gelmiştir.
Viroloji
Variola virüsü büyük ve tuğla şeklindedir ve yaklaşık 302 ila 350 nanometreye 244 ila 270 nm boyutlarındadır,[6] 186 kilobaz çifti (kbp) boyutunda tek bir doğrusal çift sarmallı DNA genomuna sahiptir ve her iki ucunda bir sap-ilmik içerir.[7][8]
Dört ortopoksvirüs insanlarda enfeksiyona neden olur: variola, vaccinia, sığır çiçeği ve maymun çiçeği. Variola virüsü doğada sadece insanları enfekte eder, ancak primatlar ve diğer hayvanlar deneysel ortamda enfekte edilmiştir. Vaccinia, sığır çiçeği ve maymun çiçeği virüsleri doğada hem insanları hem de diğer hayvanları enfekte edebilir.[9]
Çiçek virüslerinin yaşam döngüsü, farklı hücre giriş mekanizmalarına sahip birden fazla bulaşıcı forma sahip olmaları nedeniyle karmaşıktır. Çiçek virüsleri, çekirdek yerine hücrenin sitoplazmasında çoğalmaları bakımından insan DNA virüsleri arasında benzersizdir. Çoğalmak için, çiçek virüsleri diğer DNA virüsleri tarafından üretilmeyen çeşitli özel proteinler üretir, bunlardan en önemlisi viral ilişkili DNA'ya bağımlı RNA polimerazdır.
Hem zarflı hem de zarfsız virionlar bulaşıcıdır. Viral zarf, hemaglutinin de dahil olmak üzere viral spesifik polipeptitler içeren modifiye Golgi membranlarından oluşur.[7] Variola majör virüsü ya da variola minör virüsü ile enfeksiyon diğerine karşı bağışıklık kazandırır.[10]
Variola majör
Hastalığın daha yaygın, bulaşıcı formuna variola majör virüs türü neden olur.
Variola minör
Alastrim olarak da adlandırılan Variola minör virüsü, virüsün daha az yaygın ve çok daha az ölümcül bir formudur. Variola minör, çiçek hastalığı ile aynı kuluçka dönemine ve patogenetik aşamalara sahip olmasına rağmen, çiçek hastalığının %30'luk ölüm oranına kıyasla %1'den daha az bir ölüm oranına sahip olduğuna inanılmaktadır. Variola majör gibi variola minör de havadaki virüsün solunması yoluyla yayılır ve bu durum yüz yüze temas ya da fomitler aracılığıyla gerçekleşebilir. Variola minör virüsü ile enfeksiyon, daha tehlikeli olan variola majör virüsüne karşı bağışıklık kazandırır.
Variola minör çiçek hastalığına kıyasla daha az zayıflatıcı bir hastalık olduğundan, insanlar daha ayakta tedavi olabiliyorlardı ve dolayısıyla başkalarına daha hızlı bulaştırabiliyorlardı. Bu nedenle, variola minör 20. yüzyılın başlarında Amerika Birleşik Devletleri, Büyük Britanya ve Güney Afrika'yı kasıp kavurmuş, bu bölgelerde hastalığın baskın formu haline gelmiş ve böylece ölüm oranlarını hızla düşürmüştür. Variola majör ile birlikte, minör formu da artık tüm dünyadan tamamen yok edilmiştir. Son yerli variola minör vakası Ekim 1977'de Somalili bir aşçı olan Ali Maow Maalin'de görülmüş ve çiçek hastalığının Mayıs 1980'de dünya çapında tamamen ortadan kaldırıldığı resmen ilan edilmiştir.[11] Variola minör aynı zamanda beyaz çiçek, kaffir çiçeği, Küba kaşıntısı, Batı Hint çiçeği, süt çiçeği ve pseudovariola olarak da adlandırılmıştır.
Genom bileşimi
Variola majör virüsünün genomu yaklaşık 186.000 baz çifti uzunluğundadır.[12] Doğrusal çift sarmallı DNA'dan oluşur ve yaklaşık 200 gen için bir kodlama dizisi içerir.[13] Genler genellikle üst üste binmez ve tipik olarak genomun daha yakın terminal bölgesine işaret eden bloklar halinde meydana gelir.[14] Genomun merkezi bölgesinin kodlama dizisi orthopoxvirusler arasında oldukça tutarlıdır ve genlerin düzeni kordopoxvirüsler arasında tutarlıdır.[13][14]
Variola virüs genomunun merkezi, yapısal proteinler, DNA replikasyonu, transkripsiyon ve mRNA sentezi için genler de dahil olmak üzere temel viral genlerin çoğunu içerir.[13] Genomun uç kısımları orthopoksvirus suşları ve türleri arasında daha fazla farklılık gösterir.[13] Bu bölgeler konakların bağışıklık sistemlerini modüle eden proteinler içerir ve orthopoxvirus ailesi genelinde virülanstaki değişkenlikten birincil olarak sorumludur.[13] Poxviruslerdeki bu terminal bölgeler ters terminal tekrarları (ITR) dizileridir.[14] Bu diziler aynıdır ancak genomun her iki ucunda zıt yöndedir, bu da genomun sürekli bir DNA döngüsü olmasına yol açar.[14]
ITR dizilerinin bileşenleri arasında tam olarak baz eşleşmesi yapılmamış A/T bakımından zengin bir sap-ilmik döngüsü, konkatomerik DNA'yı (aynı dizinin birden fazla kopyasını içeren bir DNA uzantısı) çözmek için gerekli olan yaklaşık 100 baz çiftlik bir bölge, birkaç açık okuma çerçevesi ve değişen sayı ve uzunlukta kısa tandem olarak tekrar eden diziler bulunur.[14] Poxviridae'nin ITR'lerinin uzunluğu suşlar ve türler arasında değişir.[14] Variola majör virüsündeki viral proteinlerin çoğu için kodlama dizisi, çiçek hastalığına karşı aşılama için kullanılan ilgili bir virüs olan vaccinia genomu ile en az %90 benzerliğe sahiptir.[14]
Gen ifadesi
Variola virüsünün gen ekspresyonu tamamen konak hücrenin sitoplazması içinde gerçekleşir ve enfeksiyon sırasında belirgin bir ilerleme izler.[14] Enfeksiyöz bir virionun konak hücreye girmesinden sonra, viral mRNA sentezi 20 dakika içinde tespit edilebilir.[14]
Viral genomun yaklaşık yarısı viral DNA'nın replikasyonundan önce transkribe edilir.[14] İfade edilen genlerin ilk seti, enfekte eden virion içinde paketlenmiş önceden var olan viral makine tarafından transkribe edilir.[14] Bu genler viral DNA sentezi ve bir sonraki eksprese gen setinin transkripsiyonu için gerekli faktörleri kodlar.[14]
Çoğu DNA virüsünün aksine, variola virüsü ve diğer poxvirüslerde DNA replikasyonu enfekte hücrenin sitoplazması içinde gerçekleşir.[14] Bir konak hücrenin enfeksiyonundan sonra DNA replikasyonunun tam zamanlaması poxviridae arasında değişiklik gösterir.[14] Genomun rekombinasyonu aktif olarak enfekte olmuş hücreler içinde gerçekleşir.[14] Viral DNA replikasyonunun başlamasını takiben, bir ara gen seti geç gen ifadesinin transkripsiyon faktörlerini kodlar.[14] Geç genlerin ürünleri, yeni viryonlar için erken genlerin transkripsiyonu için gerekli transkripsiyon faktörlerinin yanı sıra viral RNA polimeraz ve yeni viral partiküller için diğer temel enzimleri içerir.[14] Bu proteinler daha sonra diğer hücreleri enfekte edebilen yeni enfeksiyöz viryonlar halinde paketlenir.[14]
Araştırma
Biri Amerika Birleşik Devletleri'nde Atlanta'daki CDC'de, diğeri de Rusya'nın Koltsovo kentindeki Vector Enstitüsünde olmak üzere iki canlı variola majör virüsü örneği kalmıştır.[15] Kalan virüs örnekleriyle yapılan araştırmalar sıkı bir şekilde kontrol edilmektedir ve her araştırma önerisinin DSÖ ve Dünya Sağlık Asamblesi (WHA) tarafından onaylanması gerekmektedir.[15] Poxvirüsler üzerine yapılan araştırmaların çoğu, model organizma olarak yakın akraba Vaccinia virüsü kullanılarak gerçekleştirilmektedir.[14] Çiçek aşısı için kullanılan Vaccinia virüsü, aynı zamanda ilgisiz hastalıklara yönelik aşılar için viral bir vektör olarak da araştırılmaktadır.[16]
Variola majör virüsünün genomu ilk olarak 1990'larda bütünüyle dizilenmiştir.[13] Tüm kodlama dizisi çevrimiçi olarak halka açıktır. Variola majör virüsü için mevcut referans dizisi, 1967'de Hindistan'da dolaşan bir türden dizilenmiştir. Ek olarak, DSÖ eradikasyon kampanyası sırasında toplanan diğer suşların örnekleri için diziler vardır.[13] Variola virüsü ve diğer poxvirüslerin açıklamalı dizilerinin eksiksiz bir veritabanı için bir genom tarayıcısı, Viral Biyoinformatik Kaynak Merkezi aracılığıyla kamuya açıktır.[17]
Genetik mühendislik
DSÖ günümüzde variola virüsünün genetik mühendisliğini yasaklamaktadır.[18] Ancak 2004 yılında, DSÖ'ye danışmanlık yapan bir komite, variola majör virüsünün kalan iki örneğinin genomunun bir işaretleyici gen eklemek üzere düzenlenmesine izin verilmesi lehinde oy kullanmıştır.[18] GFP ya da yeşil floresan protein olarak adlandırılan bu gen, virüsün canlı örneklerinin floresan ışık altında yeşil renkte parlamasına neden olacaktı. Virüsün virülansını etkilemeyecek olan bu genin eklenmesi, genomda izin verilen tek değişiklik olacaktır.[19] Komite, önerilen değişikliğin, potansiyel bir tedavinin viral örnekleri öldürmede etkili olup olmadığını değerlendirmeyi kolaylaştırarak tedavi araştırmalarına yardımcı olacağını belirtti.[19] Öneri ancak WHA tarafından onaylanırsa yürürlüğe girebilecekti. WHA 2005 yılında öneriyi görüştüğünde, araştırma önerilerini teker teker inceleyeceğini belirterek öneri üzerinde resmi bir oylama yapmaktan kaçındı.[20] Vaccinia genomuna GFP geninin eklenmesi, yakın akraba Vaccinia virüsü üzerinde yapılan araştırmalar sırasında rutin olarak gerçekleştirilmektedir.[21]
Tartışmalar
Variola virüsünün tam diziliminin kamuya açık olması, bulaşıcı virüsün yasa dışı sentezlenmesi olasılığına ilişkin endişeleri artırmıştır.[22] Variola virüsünün kuzeni olan Vaccinia, 2002 yılında NIH bilim adamları tarafından yapay olarak sentezlenmiştir.[23] Bilim insanları, viral partiküller üreten ve kendi kendini kopyalayan bir bakteriyel plazmid oluşturmak için rekombinant bir viral genomun kullanılmasını içeren daha önceden belirlenmiş bir yöntem kullandılar.[23]
2016 yılında başka bir grup, at çiçeği için kamuya açık sekans verilerini kullanarak at çiçeği virüsünü sentezledi.[24] Araştırmacılar, etkili bir aşı halihazırda mevcut olmasına rağmen, çalışmalarının çiçek hastalığı için daha güvenli ve daha etkili bir aşı oluşturmada faydalı olacağını savundular.[24]
At çiçeği virüsünün daha önce soyunun tükenmiş gibi görünmesi, variola majörün yeniden canlanabileceğine dair endişeleri artırmış ve diğer bilim insanlarının araştırmacıların amaçlarını sorgulamasına neden olmuştu.[22] Eleştirmenler, grubun kısa bir zaman dilimi içinde nispeten az maliyet veya çabayla canlı virüsü yeniden yaratabilmesini özellikle endişe verici buldu.[24] Her ne kadar DSÖ bireysel laboratuvarların bir seferde genomun %20'sinden fazlasını sentezlemesini yasaklasa ve çiçek hastalığı genom parçalarının satın alımları izlenip düzenlense de kötü niyetli bir grup birden fazla kaynaktan canlı virüs üretmek için gerekli sentetik genomun tamamını derleyebilir.[24]
Bulaşma
Çiçek hastalığı oldukça bulaşıcıydı, ancak belki de bulaşmanın yakın temas gerektirmesi ve döküntülerin başlamasından sonra meydana gelmesi nedeniyle genellikle diğer bazı viral hastalıklardan daha yavaş ve daha az yaygındı. Genel enfeksiyon oranı, bulaşıcı evrenin kısa sürmesinden de etkilenmiştir. Ilıman bölgelerde çiçek hastalığı enfeksiyonlarının sayısı kış ve ilkbahar aylarında en yüksekti. Tropikal bölgelerde mevsimsel değişim daha az belirgindi ve hastalık yıl boyunca görülüyordu.[9]
Çiçek hastalığı enfeksiyonlarının yaş dağılımı kazanılmış bağışıklığa bağlıydı. Aşı bağışıklığı zamanla azalmış ve muhtemelen otuz yıl içinde kaybolmuştur.[10] Çiçek hastalığının böcekler ya da hayvanlar tarafından bulaştırıldığı bilinmemektedir ve asemptomatik taşıyıcılık durumu yoktur.[9]
Bulaşma, genellikle enfekte bir kişinin oral, nazal veya faringeal mukozasından salınan damlacıklar olmak üzere havadaki variola virüsünün solunması yoluyla gerçekleşir. Bir kişiden diğerine bulaşma, öncelikle enfekte bir kişiyle uzun süreli yüz yüze temas yoluyla gerçekleşir.[25]
Çamaşırhane çalışanlarının kontamine yatak takımlarıyla uğraştıktan sonra çiçek hastalığına yakalanması, çiçek hastalığının kontamine nesnelerle (fomitler) doğrudan temas yoluyla yayılabileceğini düşündürmüş, ancak bunun nadir olduğu görülmüştür.[25][26] Ayrıca nadiren çiçek hastalığı binalar, otobüsler ve trenler gibi kapalı ortamlarda havada taşınan virüsle yayılmıştır.[27] Virüs plasentayı geçebilir, ancak konjenital çiçek hastalığı insidansı nispeten düşüktür.[10]
Çiçek hastalığı prodromal dönemde önemli ölçüde bulaşıcı değildir ve viral dökülme genellikle ağız ve yutakta lezyonların eşlik ettiği döküntünün ortaya çıkmasına kadar gecikir. Virüs hastalığın seyri boyunca bulaşabilir, ancak bu en sık deri lezyonlarının çoğunun sağlam olduğu döküntünün ilk haftasında gerçekleşir.[9] Lezyonların üzerinde kabuklar oluştuğunda bulaşıcılık 7 ila 10 gün içinde azalır, ancak enfekte kişi son çiçek hastalığı kabuğu düşene kadar bulaşıcıdır.[28]
Kaynakça
- ^ "Virus Taxonomy: 2018b Release". International Committee on Taxonomy of Viruses (ICTV) (İngilizce). March 2019. Erişim tarihi: 21 March 2019.
- ^ Esposito JJ, Sammons SA, Frace AM, Osborne JD, Olsen-Rasmussen M, Zhang M, ve diğerleri. (August 2006). "Genome sequence diversity and clues to the evolution of variola (smallpox) virus". Science. 313 (5788). ss. 807-12. Bibcode:2006Sci...313..807E. doi:10.1126/science.1125134. PMID 16873609. 8 Ekim 2022 tarihinde kaynağından arşivlendi. Erişim tarihi: 23 Ağustos 2020.
- ^ Li Y, Carroll DS, Gardner SN, Walsh MC, Vitalis EA, Damon IK (October 2007). "On the origin of smallpox: correlating variola phylogenics with historical smallpox records". Proceedings of the National Academy of Sciences of the United States of America. 104 (40). ss. 15787-92. Bibcode:2007PNAS..10415787L. doi:10.1073/pnas.0609268104. PMC 2000395 $2. PMID 17901212.
- ^ a b Hughes AL, Irausquin S, Friedman R (January 2010). "The evolutionary biology of poxviruses". Infection, Genetics and Evolution. 10 (1). ss. 50-59. doi:10.1016/j.meegid.2009.10.001. PMC 2818276 $2. PMID 19833230.
- ^ Duggan AT, Perdomo MF, Piombino-Mascali D, Marciniak S, Poinar D, Emery MV, ve diğerleri. (December 2016). "17th Century variola Virus Reveals the Recent History of Smallpox". Current Biology. 26 (24). ss. 3407-12. doi:10.1016/j.cub.2016.10.061. PMC 5196022 $2. PMID 27939314.
- ^ Dubochet J, Adrian M, Richter K, Garces J, Wittek R (March 1994). "Structure of intracellular mature vaccinia virus observed by cryoelectron microscopy". Journal of Virology. 68 (3). ss. 1935-41. doi:10.1128/JVI.68.3.1935-1941.1994. PMC 236655 $2. PMID 8107253.
- ^ a b Moss B (2006). "Poxviridae: the viruses and their replication". Fields BN, Knipe DM, Howley PM (Ed.). Fields Virology. 5th. 2. Philadelphia, PA: Lippincott-Raven. ss. 2905-46. ISBN 978-0-7817-6060-7.
- ^ Damon I (2006). "Poxviruses". Fields BN, Knipe DM, Howley PM (Ed.). Fields Virology. 5th. 2. Philadelphia, PA: Lippincott-Raven. ss. 2947-76. ISBN 978-0-7817-6060-7.
- ^ a b c d Atkinson W, Hamborsky J, McIntyre L, Wolfe S, (Ed.) (2005). "Smallpox" (PDF). Epidemiology and Prevention of Vaccine-Preventable Diseases (The Pink Book). 9th. Washington DC: Public Health Foundation. ss. 281-306. 6 Mart 2010 tarihinde kaynağından (PDF) arşivlendi.
- ^ a b c "Smallpox". Armed Forces Institute of Pathology: Department of Infectious and Parasitic Diseases. 9 Ekim 2007 tarihinde kaynağından arşivlendi. Erişim tarihi: 28 Ekim 2008.
- ^ "History of Smallpox - Smallpox - CDC". www.cdc.gov. 15 Şubat 2019. 14 Haziran 2020 tarihinde kaynağından arşivlendi. Erişim tarihi: 21 Mart 2019.
- ^ "Variola virus, complete genome" (İngilizce). 20 Aralık 2020. 11 Mayıs 2022 tarihinde kaynağından arşivlendi. Erişim tarihi: 11 Mayıs 2022.
- ^ a b c d e f g Thèves, C.; Biagini, P.; Crubézy, E. (1 Mart 2014). "The rediscovery of smallpox". Clinical Microbiology and Infection (İngilizce). 20 (3). ss. 210-218. doi:10.1111/1469-0691.12536. ISSN 1198-743X. PMID 24438205. 11 Mayıs 2022 tarihinde kaynağından arşivlendi. Erişim tarihi: 11 Mayıs 2022.
- ^ a b c d e f g h i j k l m n o p q r s Fields virology. 6th. Bernard N. Fields, David M. Knipe, Peter M. Howley. Philadelphia: Wolters Kluwer Health/Lippincott Williams & Wilkins. 2013. ISBN 978-1-4511-0563-6. OCLC 825740706.
- ^ a b Vogel, Gretchen (19 Kasım 2004). "WHO Gives a Cautious Green Light to Smallpox Experiments". Science (İngilizce). 306 (5700). ss. 1270-1271. doi:10.1126/science.306.5700.1270a. ISSN 0036-8075. PMID 15550627. 11 Mayıs 2022 tarihinde kaynağından arşivlendi. Erişim tarihi: 11 Mayıs 2022.
- ^ Kaynarcalidan, Onur; Moreno Mascaraque, Sara; Drexler, Ingo (26 Kasım 2021). "Vaccinia Virus: From Crude Smallpox Vaccines to Elaborate Viral Vector Vaccine Design". Biomedicines (İngilizce). 9 (12). s. 1780. doi:10.3390/biomedicines9121780. ISSN 2227-9059. PMC 8698642 $2. PMID 34944596.
- ^ "Home". Viral Bioinformatics Research Centre (İngilizce). 24 Mart 2023 tarihinde kaynağından arşivlendi. Erişim tarihi: 11 Mayıs 2022.
- ^ a b Check, Erika (1 Kasım 2004). "Unanimous vote approves tweak to smallpox genome". Nature (İngilizce). 432 (7015). s. 263. Bibcode:2004Natur.432..263C. doi:10.1038/432263a. ISSN 1476-4687. PMID 15549065. 11 Mayıs 2022 tarihinde kaynağından arşivlendi. Erişim tarihi: 11 Mayıs 2022.
- ^ a b Altman, Lawrence K. (11 Kasım 2004). "W.H.O. Panel Backs Gene Manipulation in Smallpox Virus". The New York Times (İngilizce). ISSN 0362-4331. 11 Mayıs 2022 tarihinde kaynağından arşivlendi. Erişim tarihi: 11 Mayıs 2022.
- ^ "WHO smallpox vaccine reserve gains support". CIDRAP (İngilizce). 1 Haziran 2005. 11 Mayıs 2022 tarihinde kaynağından arşivlendi. Erişim tarihi: 11 Mayıs 2022.
- ^ Daian e Silva, D. S. O.; Pinho, T. M. G.; Rachid, M. A.; Barbosa-Stancioli, D. F.; Da Fonseca, F. G. (15 Mart 2019). "The Perennial Use of the Green Fluorescent Protein Marker in a Live Vaccinia Virus Ankara Recombinant Platform Shows No Acute Adverse Effects in Mice". Brazilian Journal of Microbiology. 50 (2). ss. 347-355. doi:10.1007/s42770-019-00067-5. ISSN 1517-8382. PMC 6863200 $2. PMID 30877662.
- ^ a b "A paper showing how to make a smallpox cousin just got published. Critics wonder why". www.science.org (İngilizce). 11 Mayıs 2022 tarihinde kaynağından arşivlendi. Erişim tarihi: 11 Mayıs 2022.
- ^ a b Domi, Arban; Moss, Bernard (17 Eylül 2002). "Cloning the vaccinia virus genome as a bacterial artificial chromosome in Escherichia coli and recovery of infectious virus in mammalian cells". Proceedings of the National Academy of Sciences (İngilizce). 99 (19). ss. 12415-12420. Bibcode:2002PNAS...9912415D. doi:10.1073/pnas.192420599. ISSN 0027-8424. PMC 129459 $2. PMID 12196634.
- ^ a b c d "How Canadian researchers reconstituted an extinct poxvirus for $100,000 using mail-order DNA". www.science.org (İngilizce). 16 Mayıs 2022 tarihinde kaynağından arşivlendi. Erişim tarihi: 11 Mayıs 2022.
- ^ a b Donald K. Milton (29 Kasım 2012). "What was the primary mode of smallpox transmission? Implications for biodefense". Front Cell Infect Microbiol. 2 (150). s. 150. doi:10.3389/fcimb.2012.00150. PMC 3509329 $2. PMID 23226686.
the rarity of smallpox transmission via fomites suggests that mucosal exposure was not the primary means of transmission and is consistent with a preference for infection via the lower respiratory tract. The rarity of transmission on crowded buses and trains could be evidence that airborne transmission was not important. However, Fenner et al. (1988) state that transmission on public transport was rare because patients seldom traveled after becoming ill.
- ^ Rao AR (1972). Smallpox. 1st. Bombay: Kothari Book Depot. OCLC 723806.
- ^ "CDC Smallpox". Smallpox Overview. 2 Nisan 2013 tarihinde kaynağından arşivlendi. Erişim tarihi: 26 Aralık 2007.
- ^ Henderson DA, Inglesby TV, Bartlett JG, Ascher MS, Eitzen E, Jahrling PB, ve diğerleri. (June 1999). "Smallpox as a biological weapon: medical and public health management. Working Group on Civilian Biodefense". JAMA. 281 (22). ss. 2127-37. doi:10.1001/jama.281.22.2127. PMID 10367824.
Dış bağlantılar
 Wikimedia Commons'ta Çiçek virüsü ile ilgili çoklu ortam belgeleri bulunur.
Wikimedia Commons'ta Çiçek virüsü ile ilgili çoklu ortam belgeleri bulunur.