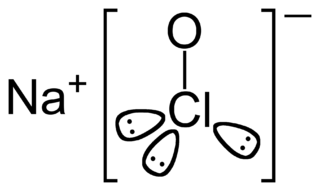
Çamaşır suyu

Çamaşır suyu, genellikle etken madde olarak sodyum hipoklorit (NaClO) içeren ağartma, temizlik ve hijyen amacıyla kullanılan kimyasal maddedir.[1]
İçerikler

Renkli kumaşları beyazlatma özelliği vardır. Bir maddeyi beyazlatır veya ağartır, amacı onun rengini çıkarmak veya açmaktır. Çamaşır suyu, oksidasyon yoluyla bu etkileri yapan bir kimyasal maddedir. Bilinen ağartıcılar; hidrojen peroksit (H2O2), sodyum hipoklorit (NaClO), sodyum perborat monohidrat (NaBO2.H2O2), sodyum perborat tetrahidrat (NaBO2.H2O2.4H2O), sodyum perkarbonat (2 Na2CO3.3H2O2) gibi bileşiklerdir. “Beyaz toz” kalsiyum hipoklorittir (Ca[OCl]2). Beyazlatma (ağartma), tekstil sanayisinde boyama işleminin ilk adımıdır.
Sağlık tehlikeleri
Çamaşır suyunun güvenliği, mevcut bileşiklerine ve konsantrasyonlarına bağlıdır. Genel olarak, çamaşır suyunun yutulması yemek borusu ve mideye zarar vererek ölüme yol açabilir. Cilt veya gözlerle temas ettiğinde tahrişe, kurumaya ve potansiyel olarak yanıklara neden olur. Çamaşır suyu buharının solunması akciğerlere zarar verebilir.[2] Çamaşır suyu kullanırken kişisel koruyucu ekipman kullanılmalıdır.
Çamaşır suyu asla sirke veya diğer asitlerle karıştırılmamalıdır, çünkü bu içte ve dışta ciddi yanıklara neden olabilecek yüksek derecede zehirli klor gazı oluşturacaktır.[3] Çamaşır suyunun amonyakla karıştırılması benzer şekilde akciğerleri yakabilen zehirli kloramin gazı üretir. Çamaşır suyunun ispirto veya aseton ile karıştırılması kloroform oluştururken, hidrojen peroksit ile karıştırılması oksijen açığa çıkaran ekzotermik ve potansiyel olarak patlayıcı bir kimyasal reaksiyonla sonuçlanır.[4]
Kullanım alanları
Sterilizasyon işlemlerinde
Çamaşır suyunun bir diğer kullanım alanı da ameliyat malzemeleri gibi araçların sterilizasyonudur.
Kimyasal savaşlarda
Çamaşır suyu, kimyasal savaşta zararlı etkilerinden korunma amacıyla kullanılabilir. Çamaşır sularında bulunan oksitleyici maddeler, bazı kimyasal silahların bileşenlerini nötralize edebilir.
Çamaşır suyunun tarihçesi
Modern çamaşır suları geliştirilmeden önce, kumaşlar genellikle bir dizi tekrarlanan kaynatma ve kül suyu, üre, potas, sülfürik asit ve yağı alınmış süt içeren asidik ve alkali maddelerle ıslatma işlemleri ile beyazlatılırdı. Keten bezi genellikle güneş ışığına maruz bırakılarak beyazlatılırdı.
- MÖ 5000 yıllarında Mısırlılar giyecekleri beyazlatmak için yıkayıp güneşte kurutmadan yararlanırlardı.
- MÖ 3000: Çamaşır suları çoğunlukla tahta küllerinden türetilirdi. Suyla karıştırılarak kül suyu oluşturulurdu. Eğer çamaşırlar belirli süre kül suyu ile ıslatılır ve güneşte kurutulursa mükemmel bir beyazlık elde edilirdi. İşlem kumaş üzerinde zararlı bir sonuç oluşturmayacak şekilde gözle takip edilerek tekrarlanırdı.
- MS 1000-1200: Hollandalılar, Avrupa toplumunun çamaşır uzmanı oldular. Sırlarını açıklamaksızın, tahriş edici etkisini azaltmak için ekşimiş sütü, kül çözeltisine eklediler. Bu, ıslatma ve güneşte kurutmanın, kül suyunun tek başına kullanıldığı zamanlara göre daha fazla tekrarlanabilme imkânı anlamına geliyordu. Fakat işlem 8 hafta sürüyordu ve çamaşırları güneşte kurutmak için serilecek geniş alanlar gerektiriyordu.
- MS 1200: Çamaşır suyu (Bleach) kelimesi İngilizce sözlüklerde ilk kez yer aldı.
- 1756: Edinburglu bilim insanı Francis Home, ekşimiş süt yerine seyreltik sülfürik asidin beyazlatma süresini 12 saate kadar kısalttığını buldu.
- 1772: Almanya doğumlu İsveçli kimyacı Karl Wilhelm Scheele, modern çamaşır sularının ana maddesi olan kloru ilk kez keşfetti. Yaklaşık 40 yıl sonra İngiliz kimyacı Sir Humphry Davy Yunancada yeşilimsi sarı kelimesinden türetilen “klor” ismini verdi.
- 1785: Evde kullanılan çamaşır suyundaki etken madde olan sodyum hipoklorit, Fransız kimyacı Claude Louis Berthollet tarafından bulundu. Berthollet’nin beyazlatıcısı kostik klorlu potas çözeltisi ile oluşturulmuştu ve ilk olarak 1789’da “Javel Suyu” olarak satıldı. Ancak her bir maddenin tam miktarının karışıma konulması zordu ve potas çok pahalı bir maddeydi.
- 1799: İskoç kimyacı Charles Tennant, Berthollet'nin klor fikrini aldı, potas yerine kireç taşı koydu ve etken beyazlatıcı olarak kalsiyum hipoklorit (CaOCl2) içeren ilk çamaşır tozunu yaptı. On yıl içinde, sadece çamaşırları değil, diğer ürünleri, özellikle yazı kâğıdını da beyazlatan çamaşır tozu bütün Avrupa’da yayıldı. Ancak toz çok fazla klor içerdiği için hâlâ çok pahalıydı.
- 1880: Louis Pasteur, sodyum hipokloritin mikrop öldürücü özelliği olduğunu belirledi.
- 1897: Sears Roebuck & Co. firması ürün kataloğuna beş ayrı çamaşır suyunu koydu.
- 1913: Oakland-Kaliforniya’da kurulu The Electro-Alkaline Co. firması geliştirdiği bir işlemle kostik soda çözeltisinin klorlanmasıyla türetilen sodyum hipoklorit (NaClO) çamaşır suyunu yaptı.
- 1922: Şirketin ismi Clorox Chemical (şu anda The Clorox Co.) olarak değişti ve sodyum hipokloritli çamaşır suyu 1 pintlik (1/8 galon ≈ 0,47 litre) şişelerde piyasaya verildi. Bundan sonra da çamaşır tozunun yerini hızla almaya başladı.
- Bugün: Sodyum hipoklorit esaslı çamaşır suları büyük ölçüde çamaşır, temizlik ve suların mikroptan arındırılması alanında kullanılmaktadır.
Dış bağlantılar
Kaynakça
- ^ "Tuvalet Temizliğinde Çamaşır Suyundan Şaşmayın". Hürriyet Gazetesi. 5 Ekim 2016 tarihinde kaynağından arşivlendi. Erişim tarihi: 12 Ağustos 2020.
- ^ "The clinical toxicology of sodium hypochlorite". 11 Mart 2024 tarihinde kaynağından arşivlendi. Erişim tarihi: 11 Mart 2024.
- ^ "Dangers of Mixing Bleach with Cleaners". 11 Mart 2024 tarihinde kaynağından arşivlendi. Erişim tarihi: 11 Mart 2024.
- ^ "Accidental mix of bleach and acid kills Buffalo Wild Wings employee". 11 Mart 2024 tarihinde kaynağından arşivlendi. Erişim tarihi: 11 Mart 2024.